Дата публикации: 2 января 2020 г.
Знатоки трендов уверяют, что h3H-маркетинг пришел на смену B2B- и B2C-маркетингу. Действительно ли открыто нечто полезное или это просто новое название для давно известных вещей? Разбираемся со специалистом по контекстной рекламе и руководителем проекта «Понятный маркетинг с Надеждой Раюшкиной».
Раньше все было просто и понятно: есть сегмент B2C, где бизнес взаимодействует с конечным потребителем, и есть сегмент B2B, где бизнес взаимодействует с бизнесом. Вот вкратце суть этих терминов, если не вдаваться в подробности и места их применения.
Вроде бы все просто: знаешь, с кем работаешь, — выбирай соответствующий сегмент и действуй по правилам, актуальным для этого сегмента. Но что же тогда такое модный h3H-маркетинг?

В полной расшифровке h3H — это human to human, то есть «человек для человека». Суть в том, что теперь в вашей маркетинговой стратегии главным становится не продукт или потребитель, а именно человек, со всеми его индивидуальными особенностями. Не важно, с кем вы имеете дело — с конечным потребителем или с представителем какой-то бизнес-империи, вы все равно имеете дело с человеком.
h3H-маркетинг: как он работает
Суть h3H-маркетинга в следующем.
-
Вы общаетесь с потребителями на их языке
Например, если человек приходит в магазин за стиральной машиной, то вы не станете «грузить» его сложными техническими терминами о том, как она была произведена и по каким принципам работают ее механизмы. Вы просто объясните ему разницу между несколькими моделями, сравните их возможности, расскажете, есть ли в них нужные покупателю функции.

Аналогично и в сфере, где нужно взаимодействовать с представителями бизнеса. Например, если я, продавая услуги контекстной рекламы, буду направо и налево говорить о CTR, KPI, LTV и т.д., вряд ли меня поймут те представители бизнеса, которые покупают мою услугу.
-
Для того чтобы общаться с потребителями на их языке, вы изучаете их проблемы
Например, в случае с выбором стиральной машины у потребителя могут быть разные проблемы: «мне негде сушить одежду», «моя машина плохо отжимает», «у меня мало места для стиралки». В случае с контекстной рекламой у предпринимателя также есть свои проблемы: «у меня упали продажи», «обо мне никто не знает», «клиенты не могут меня найти» и т.д. Слушайте, о чем говорят люди, — и предлагайте нужные им решения.

Здесь важно понимать, что в случае с продажами бизнес-сектору вы изучаете и проблемы тех, кто ищет решение, и проблемы тех, кто принимает решения.
-
Вы коммуницируете с потребителями так, как им это удобно
Если ваши покупатели хотят общаться в соцсетях — вы заводите странички в соцсетях. Если вашим покупателям удобно обсуждать детали лично — вы организуете встречи.
-
Вы готовите уникальные предложения для уникальных потребителей
Сейчас столько возможностей сегментировать аудиторию, что очень легко подстроить фактически одно и то же предложение под ту или иную аудиторию.
Например, одним покупателям стиральной машины важно, чтобы вы же ее и установили, другим важно более длительное гарантийное обслуживание, а третьи хотят, чтобы вы не предлагали им никаких дополнительных услуг, а «просто продали стиралку». Поэтому тщательно сегментируйте аудиторию и создавайте предложения, которые нужны конкретным людям.
-
Вы индивидуализируете свое общение с потребителями
Каждый человек хочет почувствовать себя уникальным и особо важным, не правда ли? Пусть вашей главной «фишкой» станет отменный сервис. Дайте возможность каждому покупателю почувствовать заботу о нем лично.

Например, в одной из гостиниц мне подарили набор косметики по уходу за телом и добавили записочку, где обратились ко мне по имени. Мелочь? Да, но это приятно и в стиле h3H-маркетинга!
-
Вы общаетесь со своими потребителями
Спрашивайте мнение потребителей, создавайте сообщество тех, кто готов помогать вам безвозмездно, то есть даром. Это же замечательно, когда на любой вопрос вы можете получить ответ от своих же покупателей! И организовать обратную связь несложно. Заведите группы в социальных сетях, запустите email-рассылку, блог и т.д. Лояльность и открытость работают на вас.

Понимая принципы и внедряя h3H-маркетинг в свой бизнес, вы выделяетесь из толпы конкурентов, а ваши клиенты становятся истинными фанатами вашего бренда.
Наверняка вы давно уже являетесь последователями именно h3H-маркетинга, просто не догадывались, как называется эта модель.
От редакции
Думаете, у вас особенный бизнес с уникальными проблемами — вы ошибаетесь. Артем Регарт подробно объясняет, почему конкуренции не существует, и дает пошаговый план, как выстроить очередь из клиентов и забыть те самые возражения «дорого» и «не сейчас»: https://navika.pro/prakticheskij-marketing/posts/konkurentov-ne-sushhestvuet
Контекстная реклама в поисковых системах «Яндекс.Директ» и Google Ads — один из быстрых способов достучаться до самых «горячих» клиентов. Как применять этот инструмент правильно, читайте в статье независимого специалиста по контекстной рекламе Арины Грединой: https://navika.pro/prakticheskij-marketing/posts/startuem-v-kontekste-yandeksgoogle-chto-nuzhno-znat
Людям не нужна агрессивная реклама — им необходимо нечто такое, что сможет запомниться и достучаться до их сердец, считает Майкл Стелзнер, автор книги «Контент-маркетинг. Новые методы привлечения клиентов в эпоху Интернета»
. Мы прочли ее для вас и сделали саммари основных идей: https://navika.pro/poleznye-knigi/posts/majkl-stelzner-kontentmarketing-novye-metody-privlecheniya-klientov-v-epoxu-interneta
h3H-маркетинг: как стать лучшим партнером для клиента
Если вы готовы выйти из зоны комфорта – значит, пора двигаться вперед. Как клиент с двадцатилетним стажем ведущих производителей FMCG в системе маркетинга и NPD (new product development), хочу показать вам «слепую зону» развития.
Есть два типа поставщиков: первый тип это «партнеры», которых ты принимаешь в свою команду за рыночное лидерство компании; другие, это «продавцы», которые вываливают на тебя весь ассортимент из своего KPI-листа. Это поглотители времени, поэтому второй встречи обычно не бывает. Основное отличие между ними только одно – понимание рынка клиента и предложение ему конкретного решения для этого рынка для существующих условий клиента. То есть, качественный маркетинг. Именно! Маркетинг в продажах, как и в b2c, создает добавочную стоимость. В работе с конечным покупателем работает аналогичный подход: базовые продукты для основных потребностей (обычно частные торговые марки) и брендовые продукты с добавочной стоимостью за попадание в конкретный мотив покупателя. В обоих секторах рынка базовый катализатор успеха – h3h (human to human) marketing. Пока люди едят, дышат и развлекаются, этот инструмент будет позвоночником любого бизнеса. Я понимаю, что h3h и есть маркетинг, но намеренно использую этот плеоназм, чтобы акцентировать на недооцененном инструменте в сфере продаж. Рассмотрим «базовые» и «брендовые» индикаторы двух типов в b2b.
«Продавцы» занимаются массовым, обычно биржевым, товаром. Из-за подверженности демпингу их полем для прибыли остается работа с сервисом и оптимизация внутренних затрат. Они сфокусированы на системе продаж здесь и сейчас, на ценовом предложении – как на основном преимуществе; они не задумываются о развитии прибыли в перспективе. В их системе маркетинг играет роль декоратора рекламных материалов.
«Партнеры» хорошо ориентируются не только на своем рынке, но и на рынке клиента. Очень часто они приходят к клиенту с инновационными предложениями, которые уже описаны в терминах динамики рынка клиента. Обычно у них есть четкие цели и план их достижения; у них хорошо организованный бизнес. В этих компаниях маркетинг определяет программу капитализации бизнеса. Поставщики – «партнеры» понимают, что доверительные отношения и экспертность – надежная инвестиция в бизнес, включая кризисные времена. При любом шторме экономики и требованиям тендерной системы клиенты держатся за тех, кому доверяют. В маркетинговых услугах смена партнера по причине более низкой цены чаще приводит к обратному эффекту – к увеличению затрат.
Но если вернуться к сырью, упаковке и оборудованию, то «партнеры» в этой сфере встречаются гораздо реже, и в этом их уникальность. Сама структура и психология этих компаний выстроена от рынка, а не от ассортимента на складе по выгодным ценам. За семь лет работы в компании
У вас не возникает вопроса: «А почему поставщику сырья нужно окучивать маркетинг компании, а не закупщика или технолога?». Отличный вопрос. Ответ – в разделе №2 данной публикации.
А пока рассмотрим точки сборки партнерского подхода к вашим клиентам и ответим на вопрос: «Как перейти на более качественный уровень партнерства?». Все по порядку.
1. Конечный покупатель начинает и выигрывает
Суть маркетинга в b2b сводится к пониманию отраслевого рынка и пониманию конечного покупателя клиента. Если ваш клиент – производитель готового продукта для покупателя, он будет использовать эту власть над вами, потому что покупатель готового продукта является двигателем всей отраслевой цепочки и «обналичивает» усилия этой цепочки, он оценивает стоимость этих усилий и выводит товар из системы в обмен на деньги. Поэтому ключевые сети могут давить на производителя, так как они еще ближе к конечному покупателю.
Если вы понимаете динамику на рынке готового продукта, тогда вы можете предложить клиенту интересные решения, не дожидаясь, пока клиенты получат информацию от своих покупателей и постучатся с ней к вам. Этого времени на опережение обычно хватает, чтобы оторваться от конкурентов и выстроить партнерские отношения. Есть альтернативный сценарий – дождаться выхода Мышки и досмотреть весь перфоманс про Репку. Но если вы уже понимаете, что миграция ценностей покупателя «дергает» вашего клиента, а он в свою очередь с задержкой – вас и ваших конкурентов, тогда воспользуйтесь инертностью процесса и поднимитесь на более экспертный уровень, который помогает продавать даже биржевое сырье прицепом к уникальному ингредиенту.
Пример. На рынках с падающим спросом «калорийных» продуктов (майонез, хлеб) каждый из производителей пытается остановить это падение разными способами и встроиться в тренд «здорового питания». Производители майонеза пытаются дистанцироваться от образа жирного продукта, и называет продукт «соусом», используют клеймы «light», «польза», «натурально» и т.д. Почему бы поставщикам сырья не предложить производителям этого продукта функциональный ингредиент, который будет ассоциироваться с пользой или необходимым эффектом для здорового питания, и поможет в продвижении продукта и дифференциации относительно конкурентов? Этот функциональный ингредиент гарантирует привязку клиента к вам, так как этот «актив» будет сертифицирован в составе продукта. И если он уникален, то сотрудничество будет поддерживаться до тех пор, пока продукт будет жизнеспособен на рынке. Вместе с «активом» для продукта, конечно, нужно продавать также базовое сырье для производства.
2. Квест «Где искать ЛПР и как ему продать идею»
В зависимости от отрасли и уровня вашего клиента заход к нему может быть с трех сторон.
Маркетологи
Роль и полномочия маркетинга выросли. До этого парадом по развитию новых продуктов командовало производство. Но после оптимизации внутренних затрат в кризис 2008 затянутые пояса себестоимости не оправдывают ожидания от уровня прибыли. На первый план по наращиванию добавленной стоимости вышел маркетинг. Его главенство в развитых компаниях-клиентах очевидно.
Маркетологи управляют продуктом и во многом определяют качество и особые требования к сырью и материалам. Например, в рамках эко-бренда нужна биоразлагаемая упаковка, специальные ингредиенты, вызывающие доверие к концепту бренда. Этот список уходит к технологам и закупщикам на проработку. Незаменимость маркетинга при входе в партнерство связана еще и с тем, что именно сотрудники маркетинга отвечают за защиту идеи нововведений по вопросам инвестиций, то есть они могут продать бизнесу вашу идею. Их язык, навыки презентации и понимание стратегии компании справятся с проведением идеи лучше, чем усилия технологов.
Технологи должны знать об идее, чтобы поддержать ее со стороны возможности производства, но полагаться на них в помощи презентации бизнесу нет смысла. Их язык и аргумент новых разработок непонятен для ЛПР.
Как продать идею маркетингу?
Маркетинг должен быть уверен в следующем:
- это будет инструментом по аргументации добавленной стоимости конечному покупателю;
- это можно легко объяснить и потратить минимум бюджета на коммуникации;
- это позволит оторваться от преследования конкурентов на время;
- это в рамках стратегии компании, бренда и востребовано на рынке.
Им просто нужен продукт с гарантией успеха. Если это есть, тогда им будет легче продать идею руководству и пояснить инвестиции в запуск и продвижение.
Что может помочь в работе с маркетингом, кроме вау-идеи?
Только вау-реализация: презентация на языке маркетинга; документы, которые подтверждают концепт (возможность употреблять слова «здоровье» «рекомендовано для детей») и другие RTB; сертификаты на использование клеймов, исследования – все, что облегчает запуск новинки. Если маркетолог взвешивает и понимает, что для запуска новинки придется потерять два года на документацию (испытания в клинике), то вряд ли сделка состоится. Я занималась NPD в хлебной отрасли более пяти лет. Мне очень хотелось, чтобы поставщик активного сырья взял на себя часть груза по сертификации для нанесения информации на упаковку. Тогда можно было бы говорить о гарантированном объеме для поставщика при таком жесте партнерства. Я рекомендую сместить центр тяжести бюджета на клиентов с ненужных подарков и сувениров на статью «сертификация», на подачу идеи или готовый концепт для продукта.
Технологи
Роль и полномочия. Это незаменимый канал общения в среде клиента при предложении сырья для модификации товара; вторая скрипка в продвижении других идей, так как подтверждение об использовании ингредиента в индустриальных масштабах необходимо при оценке сделки по нему.
Как продать им идею?
Давайте подумаем: за что отвечают технологи, о чем они беспокоятся в связи с использованием нового ингредиента? Это стабильность рецептуры в течение заявленного срока, стабильное качество, полная документация по сырью. Поэтому влияние на эту группу специалистов будет именно в прикладном ключе к продукту и его производству. В вашей компании должен быть обязательно эксперт, который сможет снять возражения группы технологов.
Технологи охотно и по-человечески делятся задачами по новым продуктам, которые ставит перед ними маркетинг. Поэтому при правильном подходе к ним вы получите достоверную информацию в полном объеме.
Специалисты по закупке
Роль и полномочия. Закупка чаще всего работает по заданию технологов, ее сотрудники ищут конкретное сырье с конкретными параметрами. Если к этому добавить их KPI на экономию бюджета по закупке (цены, savings), сроки поставки, стабильность качества, возможность хранения сырья на складе поставщика до момента производства, то можно получить слепок для коммерческого предложения.
Если ваше предложение – аналог с приятными дополнениями сервиса или цены, нужно идти к ним. Через них можно получить информацию о требованиях к ингредиенту и контакты ЛПР.
Есть еще один канал принятия решений. В компаниях среднего размера собственник решает все вопросы по развитию линейки продукта. Поэтому в нем может быть все три роли, указанные выше.
3. Высший уровень доверия, или как пройти инициацию к NPD клиента
Достичь доверительного уровня, когда клиент рассказывает вам план о новых разработках – это основная цель компании, которая ориентирована на «партнерство». На этом уровне никто не напоминает о коммерческой тайне и не сомневается в экспертности вас как поставщика. Этим жестом вас принимают в партнерство. Но как этого достичь?
Вы должны продемонстрировать, что вы понимаете отрасль, ситуацию на рынке клиента и его позицию на этом рынке. Можете начать с PESTLE-анализа для выбранной отрасли, проанализировать, на каком бизнес-этапе находится клиент, откуда он черпает прибыльность и на что ориентируется. С помощью ваших компаний-партнеров и поставщиков оцените, какой ассортимент вы сможете предложить в рамках потребностей вашего клиента. Хорошие отношения со всеми тремя каналами общения тоже важны для партнерства.
4. Готовы ли вы к изменениям при переходе к «партнерству»
При сравнении основного алгоритма «продавца» и «партнера» становится очевидно, куда направить усилия для построения крепких и равных отношений с клиентами.
Модель «продавца» по захвату внимания клиента и реализации товара:
1. Сотрудники отдела продаж взвешивают свои KPI и планы на период.
2. Анализируются клиенты, которые «помогут» выполнить план.
3. Встреча с клиентом и пять-семь «шагов продаж».
4. Конверсия усилий не измеряется, победы и ошибки не анализируются.
Модель «партнера» по вовлечению клиента в сотрудничество:
1. Анализ рынка клиента и его позиционирования на нем; понимание, как конечный покупатель стимулирует клиента к изменениям.
2. Создание ассортиментного предложения под конкретного клиента.
3. Определение с каналом предложения, который приведет к ЛПР.
4. Создание и проведение выдающейся презентации с индивидуальным предложением для выбранного канала предложения.
5. Ведение статистики и аналитики всех шагов при работе с клиентом.
Как вы понимаете, тип «партнера» имеет совсем другие цели и приоритеты, чем «продавец». По сути, это совсем другая компания. Вам придется полностью перестроить подход к клиенту. И здесь нужно понимать, что застрять посередине двух типов невозможно! Причем, я повторюсь, что «партнер» тоже может предлагать биржевой товар. «Партнерство» – это форма индивидуального подхода, а не ассортимент.
Для уровня «партнерства» необходим высокий уровень аналитики и квалификация сотрудников, которые могут в потоке информации поймать «золотых рыбок». Не исключаю, что части персонала будет не по пути с новой концепцией развития. Но для тех, кто готов к изменениям и готов учиться, это будет полезно.
С изменением угла зрения на бизнес изменится также структура, мотивация и культура организации. Культура меняется даже потому, что сотрудник «влюбляется» в товар. Он не сможет вести интерес клиента, если сам не верит в это. Сложно любить восьмизначный артикул из 1С в виде куска воска, но свет и тепло, которое есть у готовой свечи, вызывает больше уважения. Настрой всех сотрудников компании – на потенциал сырья в готовом продукте, из которого клиент сотворит новую форму для улучшения жизни людей.
При переходе к партнерству очень важно стимулировать обмен лучшим опытом между сотрудниками и оттачивать все качества, которые необходимы для этого.
Еще очень важный момент – учитывайте время для развития нового продукта клиента. Он будет выбирать, сравнивать, делать рецепт и документы. У «продавцов» нет этого времени. Их товар не уникален и этим уязвим по прибыльности. Поэтому имейте терпение при работе с уникальным предложением для клиента.
Хочу сказать, что каждый выбирает себе тип сотрудничества по размеру амбиций и оценке возможностей. Но искренняя заинтересованность в ситуации клиента никому еще не мешала в b2b. Как далеко заходить в этом – решать вам.
 Манн, Иванов и Фербер
2015
Манн, Иванов и Фербер
2015Казанцев М.

Алексей Катернюк, Мария Терских
h3H или head to head fantasy football — Опыт командной игры в FF — Блоги
- Главная
- Футбол
- Матчи
- Новости
- Блоги
- Статусы
- Трансферы
- Россия
- Лига чемпионов
- Лига Европы
- Англия
- Испания
- Италия
- Германия
- Франция
- Сборные
- Олимп-ФНЛ
- Евро-2020
- Ливерпуль
- Тоттенхэм
- Челси
- Арсенал
- Зенит
- Барселона
- Реал Мадрид
- Спартак
- Сборная России
- Манчестер Юнайтед
- Салах
- Сон Хын Мин
- Азар
- Месси
- Роналду
- Головин
- Мбаппе
- Суарес
- Дзюба
- Неймар
- Хоккей
- Матчи
- Новости
- Блоги
- Статусы
- КХЛ
- НХЛ
- Кубок Первого канала
- Кубок Шпенглера
- Молодёжный чемпионат мира
- Шведские игры
- Чешские игры
- Юниорский чемпионат мира
- Зимняя классика НХЛ
- ФОНБЕТ Матч звезд КХЛ 2020
- Вашингтон
- СКА
- ЦСКА
- Авангард
- Тампа-Бэй
- Питтсбург
- Спартак
- Динамо Москва
- Рейнджерс
- Нью-Джерси
- Александр Овечкин
- Артемий Панарин
- Никита Кучеров
- Андрей Свечников
- Евгений Малкин
- Евгений Кузнецов
- Сергей Бобровский
- Андрей Василевский
- Никита Гусев
- Илья Михеев
- Баскетбол
- Матчи
- Новости
- Блоги
- Статусы
- НБА
- Turkish Airlines EuroLeague
- Единая лига ВТБ
- НБА плей-офф
- Зарплаты НБА
- Лейкерс
- ЦСКА
- Бостон
- Голден Стэйт
- Милуоки
- Торонто
- Чикаго
- Сан-Антонио
- Оклахома-Сити
- Зенит
- Сборная России
- Сборная США
- Леброн Джеймс
- Стефен Карри
- Кобе Брайант
- Джеймс Харден
- Кайри Ирвинг
- Кевин Дюрэнт
- Кавай Ленард
- Расселл Уэстбрук
- Алексей Швед
- Яннис Адетокумбо
- Авто
- Гонки
- Новости
- Блоги
- Статусы
- Формула 1
- MotoGP
- Формула 2
- Формула E
- Ралли Дакар
- Шелковый путь
- Феррари
- Макларен
- Ред Булл
- Мерседес
- Уильямс
- Хаас
- Торо Россо
- Рейсинг Пойнт
- Рено
- Альфа Ромео
- Льюис Хэмилтон
- Себастьян Феттель
- Роберт Кубица
- Даниил Квят
- Кими Райкконен
- Фернандо Алонсо
- Шарль Леклер
- Валттери Боттас
- Даниэль Риккардо
- Макс Ферстаппен
- Теннис
- Новости
- Блоги
- Статусы
- US Open
- Australian Open
- Ролан Гаррос
- Уимблдон
- Мужчины
- Женщины
- Кубок Дэвиса
- Новак Джокович
- Роджер Федерер
- Рафаэль Надаль
- Наоми Осака
- Симона Халеп
- Мария Шарапова
- Серена Уильямс
- Карен Хачанов
- Даниил Медведев
- Александр Зверев
- Эшли Барти
- Бокс/MMA/UFC
- Новости
- Блоги
- Статусы
- UFC
- MMA
- Бокс
- UFC 246
- UFC 247
- Бой Федора Емельяненко
- Бой Конор Макгрегор — Дональд Серроне
- Бой Хабиб – Тони Фергюсон
- Хабиб Нурмагомедов
- Конор Макгрегор
- Федор Емельяненко
- Александр Усик
- Василий Ломаченко
- Энтони Джошуа
- Деонтей Уайлдер
- Сауль Альварес
- Джон Джонс
- Александр Емельяненко
- Ставки
- Фигурное катание
- Новости
- Блоги
- Статусы
- Гран-при
- Чемпионат Европы
- Чемпионат мира
- Чемпионат России по фигурному катанию
- Сборная России
- Сборная Японии
- Сборная США
- Сборная Канады
- Сборная Франции
- Алина Загитова
- Евгения Медведева
- Александра Трусова
- Анна Щербакова
- Михаил Коляда
- Елизавета Туктамышева
- Этери Тутберидзе
- Татьяна Тарасова
- Биатлон
- Гонки
- Новости
- Блоги
- Статусы
- Кубок мира
- Кубок IBU
- Чемпионат мира-2020
- Ижевская винтовка
- Сборная России
- Сборная России жен
- Сборная Германии
- Сборная Германии жен
- Сборная Норвегии
- Сборная Норвегии жен
- Александр Логинов
- Мартен Фуркад
- Йоханнес Бо
- Доротея Вирер
- Дмитрий Губерниев
- Лиза Виттоцци
- Светлана Миронова
- Екатерина Юрлова
- Дмитрий Малышко
- Стиль
- Лыжи
- Легкая атлетика
- Волейбол
- Регби
- Олимпиада-2020
- Американский футбол
- Бадминтон
- Бейсбол
- Бильярд/снукер
- Борьба
- Бобслей/сани/скелетон
- Велоспорт
- Водные виды
- Гандбол
- Гимнастика
- Гольф
- Гребля
- Единоборства
- Керлинг
- Конный спорт
- Коньки/шорт-трек
- Мини-футбол
- Настольный теннис
- Парусный спорт
- Пляжный футбол
- Покер
- Современное пятиборье
- Стрельба
- Триатлон
- Тяжелая атлетика
- Фехтование
- Хоккей на траве
- Хоккей с мячом
- Шахматы
- Экстремальные виды
- Экзотические виды
- Промокоды
- Финансы
- Прочие
- Главная
- Футбол
- Хоккей
- Баскетбол
- Авто
- Теннис
- Бокс/MMA/UFC
- Ставки
- Фигурное катание
- Биатлон
- Стиль
- Лыжи
- Легкая атлетика
- Волейбол
- Регби
- Олимпиада-2020
- Американский футбол
- Бадминтон
- Бейсбол
- Бильярд/снукер
- Борьба
- Бобслей/сани/скелетон
- Велоспорт
- Водные виды
- Гандбол
- Гимнастика
- Гольф
- Гребля
- Единоборства
- Керлинг
- Конный спорт
- Коньки/шорт-трек
- Мини-футбол
- Настольный теннис
- Парусный спорт
- Пляжный футбол
- Покер
- Современное пятиборье
- Стрельба
- Триатлон
- Тяжелая атлетика
- Фехтование
- Хоккей на траве
- Хоккей с мячом
- Шахматы
- Экстремальные виды
- Экзотические виды
- Промокоды
- Финансы
- Матч-центр
- Футбол
- Хоккей
- Баскетбол
- Авто
- Биатлон
- Новости
- Футбол
- Хоккей
- Баскетбол
- Теннис
- Авто
- Бокс/MMA/UFC
- Биатлон
- Фигурное катание
- Прочие
- Блоги
- Блоги
- Форумы
- Статусы
- Комментарии
- Футбол
- Россия
- Сборные
- Лига чемпионов
- Лига Европы
- Англия
- Испания
- Италия
- Германия
- Франция
- Украина
- Южная Америка
- Голландия
- Португалия
- Африка
- Любительский
- Азия
- Беларусь
- ФНЛ
- Хоккей
- 🏒Чемпионат мира по хоккею 2019
- Россия
- Сборные
- НХЛ
- КХЛ
- Баскетбол
- Turkish Airlines Euroleague
- Россия
- НБА
- Зарплаты НБА
- Еврокубки
- Сборные
- Еврочемпионаты
- Женский баскетбол
- Биатлон
- Чемпионат мира по биатлону
- Кубок мира по биатлону
- Теннис
- ATP
- WTA
- Кубок Дэвиса
- Кубок Федерации
- Ролан Гаррос
- Авто
- Формула-1
- Мото
- Ралли
- ДТМ
- Другие серии
- Бокс/MMA/UFC
- Бокс Профи
- ММА
- Прочее
- Фигурное катание
- Чемпионат мира по фигурному катанию
- Прочие
- Американский футбол
- Бадминтон
- Бейсбол
- Бильярд/снукер
- Борьба
- Бобслей/сани/скелетон
- Велоспорт
- Водные виды
- Волейбол
- Гандбол
- Гимнастика
- Гольф
- Гребля
- Единоборства
- Керлинг
- Конный спорт
- Коньки/шорт-трек
- Легкая атлетика
- Лыжи
- Мини-футбол
- Настольный теннис
- Парусный спорт
- Пляжный футбол
- Покер
- Регби
- Современное пятиборье
- Стрельба
- Триатлон
- Тяжелая атлетика
- Фехтование
- Хоккей на траве
- Хоккей с мячом
- Шахматы
- Экстрим
- Экзотические виды
- Трансферы
- Россия
- Англия
- Испания
- Италия
- Германия
- Франция
- Барселона
- Реал Мадрид
- Манчестер Юнайтед
- Ливерпуль
- Манчестер Сити
- Зенит
- Спартак
- ЦСКА
- Ювентус
- Подкасты
- Статусы
- Популярные
- Новые
- Рейтинг букмекеров
- Бонусы букмекеров
- Легальные
- Зарубежные
- Киберспортивные
- Мобильные
- Российские
- С кэшбеком
- Fantasy
- Fantasy
- Прогнозы
- Редакционные игры
- Киберспорт
- Прогнозы на спорт
Что означает h3H? -определения h3H
Вы ищете значения h3H? На следующем изображении вы можете увидеть основные определения h3H. При желании вы также можете загрузить файл изображения для печати или поделиться им со своим другом через Facebook, Twitter, Pinterest, Google и т. Д. Чтобы увидеть все значения h3H, пожалуйста, прокрутите вниз. Полный список определений приведен в таблице ниже в алфавитном порядке.
Основные значения h3H
На следующем изображении представлены наиболее часто используемые значения h3H. Вы можете записать файл изображения в формате PNG для автономного использования или отправить его своим друзьям по электронной почте.Если вы являетесь веб-мастером некоммерческого веб-сайта, пожалуйста, не стесняйтесь публиковать изображение определений h3H на вашем веб-сайте.Все определения h3H
Как упомянуто выше, вы увидите все значения h3H в следующей таблице. Пожалуйста, знайте, что все определения перечислены в алфавитном порядке.Вы можете щелкнуть ссылки справа, чтобы увидеть подробную информацию о каждом определении, включая определения на английском и вашем местном языке.Что означает h3H в тексте
В общем, h3H является аббревиатурой или аббревиатурой, которая определяется простым языком. Эта страница иллюстрирует, как h3H используется в обмена сообщениями и чат-форумах, в дополнение к социальным сетям, таким как VK, Instagram, Whatsapp и Snapchat. Из приведенной выше таблицы, вы можете просмотреть все значения h3H: некоторые из них образовательные термины, другие медицинские термины, и даже компьютерные термины. Если вы знаете другое определение h3H, пожалуйста, свяжитесь с нами. Мы включим его во время следующего обновления нашей базы данных. Пожалуйста, имейте в информации, что некоторые из наших сокращений и их определения создаются нашими посетителями. Поэтому ваше предложение о новых аббревиатур приветствуется! В качестве возврата мы перевели аббревиатуру h3H на испанский, французский, китайский, португальский, русский и т.д. Далее можно прокрутить вниз и щелкнуть в меню языка, чтобы найти значения h3H на других 42 языках.Фтороводород — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 29 октября 2019; проверки требуют 11 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 29 октября 2019; проверки требуют 11 правок. Не следует путать с Hf.| Фтороводород | |||
|---|---|---|---|
 ( ({{{картинка малая}}}) | |||
| Систематическое наименование | Фтороводород | ||
| Традиционные названия | фтористый водород, гидрофторид; водорода фторид | ||
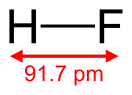
| Хим. формула | HF | ||
| Рац. формула | HF | ||
| Состояние | газ или подвижная жидкость | ||
| Молярная масса | 20,01 г/моль | ||
| Плотность | 0,99 г/см³ | ||
| Энергия ионизации | 15,98 ± 0,01 эВ[1] | ||
| Температура | |||
| • плавления | −83,4 °C | ||
| • кипения | 19,54 °C | ||
| Критическая точка | 188 | ||
| Энтальпия | |||
| • образования | −273,3 кДж/моль | ||
| Давление пара | 783 ± 1 мм рт.ст.[1] | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 3,17 | ||
| Растворимость | |||
| • в воде | 72,47 (20 °C) | ||
| Рег. номер CAS | 7664-39-3 | ||
| PubChem | 14917 | ||
| Рег. номер EINECS | 231-634-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | MW7875000 | ||
| ChEBI | 29228 | ||
| ChemSpider | 14214 | ||
| Токсичность | Чрезвычайно ядовит, СДЯВ | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Фтороводоро́д (фтористый водород, гидрофторид, фторид водорода, HF) — бесцветный токсичный (очень ядовитый) газ (при стандартных условиях) с резким запахом, при комнатной температуре существует преимущественно в виде димера H2F2, ниже 19,9°C — бесцветная подвижная летучая жидкость. Смешивается с водой в любом отношении с образованием фтороводородной (плавиковой) кислоты. Образует с водой азеотропную смесь с концентрацией 35,4 % HF.
Молекула фтороводорода сильно полярна, μ = 0,64⋅10−29 Кл·м. Фтороводород в жидком и газообразном состояниях имеет большую склонность к ассоциации вследствие образования сильных водородных связей. Энергия водородных связей FH•••FH приблизительно составляет 42 кДж/моль, а средняя степень полимеризации в газовой фазе (при температуре кипения) ≈4. Даже в газообразном состоянии фтороводород состоит из смеси полимеров H2F2, H3F3, H4F4, H5F5, H6F6. Простые молекулы HF существуют лишь при температурах выше 90 °C. Вследствие высокой прочности связи термический распад фтороводорода становится заметным лишь выше 3500 °C (что выше температуры плавления вольфрама — самого тугоплавкого из металлов). Для сравнения — у воды термический распад становится заметным при температурах выше 2000 °C.
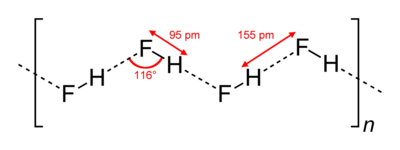
В кристаллическом состоянии HF образует орторомбические кристаллы, состоящие из цепеобразных структур: угол HFH = 116 °, d(F-H) = 95 пм, d(F•••H) = 155 пм. Аналогичные зигзагообразные
цепи с углом HFH = 140°) имеют и полимеры HF, существующие в газовой фазе.
Физические свойства[править | править код]
- Химические свойства HF зависят от присутствия воды. Сухой фтористый водород не действует на большинство металлов и не реагирует с оксидами металлов. Однако если реакция начнется, то дальше она некоторое время идет с автокатализом, так как в результате взаимодействия количество воды увеличивается:
- MgO+2HF→MgF2+h3O{\displaystyle {\mathsf {MgO+2HF\rightarrow MgF_{2}+H_{2}O}}}
- Жидкий HF — сильный ионизирующий растворитель. Все электролиты, растворённые в нём, за исключением хлорной кислоты HClO4, являются основаниями:
- HCl+2HF⇄h3Cl++HF2−{\displaystyle {\mathsf {HCl+2HF\rightleftarrows H_{2}Cl^{+}+HF_{2}^{-}}}}
- В жидком фтороводороде кислотные свойства проявляют соединения, которые являются акцепторами фторид-ионов, например, BF3, SbF5:
- BF3+2HF→h3F++[BF4]−{\displaystyle {\mathsf {BF_{3}+2HF\rightarrow H_{2}F^{+}+[BF_{4}]^{-}}}}
- Амфотерными соединениями в среде жидкого фтороводорода являются, например, фториды алюминия и хрома(III):
- 3NaF+AlF3→3Na++[AlF6]3−{\displaystyle {\mathsf {3NaF+AlF_{3}\rightarrow 3Na^{+}+[AlF_{6}]^{3-}}}}
- (AlF3 — как кислота)
- AlF3+3BF3→Al3++3[BF4]−{\displaystyle {\mathsf {AlF_{3}+3BF_{3}\rightarrow Al^{3+}+3[BF_{4}]^{-}}}}
- (AlF3 — как основание)
- Фтороводород в газообразном состоянии и в виде водного раствора реагирует с диоксидом кремния:
- При условии, если фтороводород в газообразном состоянии:
- 4HF+SiO2→SiF4+2h3O{\displaystyle {\mathsf {4HF+SiO_{2}\rightarrow SiF_{4}+2H_{2}O}}}
- При условии, если фтороводород в виде водного раствора:
- 6HF+SiO2→h3[SiF6]+2h3O{\displaystyle {\mathsf {6HF+SiO_{2}\rightarrow H_{2}[SiF_{6}]+2H_{2}O}}}
- Фтороводород неограниченно растворяется в воде, при этом происходит ионизация молекул HF:
- 2HF+h3O⇄HF2−+h4O+{\displaystyle {\mathsf {2HF+H_{2}O\rightleftarrows HF_{2}^{-}+H_{3}O^{+}}}}
- Kd= 7,2⋅10−4
- HF+F−⇄HF2−{\displaystyle {\mathsf {HF+F^{-}\rightleftarrows HF_{2}^{-}}}}
- Kd= 5,1
- 2HF+h3O⇄HF2−+h4O+{\displaystyle {\mathsf {2HF+H_{2}O\rightleftarrows HF_{2}^{-}+H_{3}O^{+}}}}
- Водный раствор фтороводорода (плавиковая кислота) является кислотой средней силы. Соли плавиковой кислоты называются фторидами. Большинство их труднорастворимо в воде, хорошо растворяются лишь фториды NH4, Na, К, Ag(I), Sn(II), Ni(II) и Mn(II). Все растворимые соли плавиковой кислоты очень ядовиты (в больших дозах).
Фтор со взрывом взаимодействует с водородом даже при низких температурах и (в отличие от хлора) в темноте с образованием фтороводорода:
- h3+F2→2HF{\displaystyle {\mathsf {H_{2}+F_{2}\rightarrow 2HF}}}
В промышленности фтороводород получают при взаимодействии плавикового шпата и сильных нелетучих кислот (например, серной):
- CaF2+h3SO4→CaSO4+2HF{\displaystyle {\mathsf {CaF_{2}+H_{2}SO_{4}\rightarrow CaSO_{4}+2HF}}}
Процесс проводят в стальных печах при 120—300 °C, по сравнению с аналогичными реакциями получения других галогеноводородов, реакция получения фтороводорода из фторидов идет очень медленно. Части установки, служащие для поглощения фтороводорода, делаются из свинца.
Фтористый водород (гидрофторид) обладает резким запахом, очень ядовит, дымит на воздухе (вследствие образования с парами воды мелких капелек раствора) и сильно разъедает стенки дыхательных путей. Фтороводород обладает слабыми наркотическими свойствами.
Как и некоторые другие производные фтора, HF высокоопасен в обращении.
Подробнее о токсикологии фтороводорода см в ст. Плавиковая кислота.
Применяют для получения криолита, фтористых производных урана, фреонов, фторорганических веществ, матового травления силикатного стекла (плавиковую кислоту — для прозрачного травления). Необычная растворимость биологических молекул в жидком фтороводороде без разложения (напр., белков) используется в биохимии. Добавление в жидкий фтороводород акцепторов фтора позволяет создавать сверхкислые среды.
- Известный писатель-фантаст Иван Ефремов написал повесть «Сердце змеи», в которой описал гипотетическую жизнь, образовавшуюся на планете, где основную роль в природе играет не кислород, а фтор, а вместо воды поверхность планеты покрыта океанами фтороводорода. На эту мысль писателя навела глубокая аналогия между свойствами воды и фтороводорода.
- Фтороводород реагирует со стеклом, поэтому он хранится в пластмассовых ёмкостях. При хранении фтороводорода в стеклянной посуде прибегают к покрытию стекла парафином для защиты его от фтороводорода.
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001.
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. М.: Химия, 1994.
Угольная кислота — Википедия
У́гольная кислота́ — слабая двухосновная кислота с химической формулой H2CO3, образуется в малых количествах при растворении углекислого газа в воде[1], в том числе и углекислого газа из воздуха. В водных растворах неустойчива. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Угольная кислота существует в водных растворах в равновесии с диоксидом углерода, причём равновесие сильно сдвинуто в сторону разложения кислоты.
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 130 пм.
Безводная угольная кислота представляет собой бесцветные кристаллы, устойчивые при низких температурах, сублимирующиеся при температуре –30 °C, а при дальнейшем нагревании полностью разлагающиеся. Поведение чистой угольной кислоты в газовой фазе исследовано в 2011 г. австрийскими химиками[2].
Равновесие в водных растворах и кислотность[править | править код]
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
- CO2⋅h3O(p)⇄h3CO3(p){\displaystyle {\mathsf {CO_{2}\cdot H_{2}O_{(p)}\rightleftarrows H_{2}CO_{3(p)}}}}, константа равновесия при 25 °C Kp=[h3CO3][CO2⋅h3O]=1,70⋅10−3{\displaystyle K_{p}={\frac {\mathsf {[H_{2}CO_{3}]}}{\mathsf {[CO_{2}\cdot H_{2}O]}}}=1,70\cdot 10^{-3}}
Скорость прямой реакции 0,039 с−1, обратной — 23 с−1.
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
- CO2⋅h3O(p)⇄CO2↑+ h3O{\displaystyle {\mathsf {CO_{2}\cdot H_{2}O_{(p)}\rightleftarrows CO_{2}\uparrow +\ H_{2}O}}}
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов).
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
- h3CO3+ h3O⇄HCO3−+ h4O+{\displaystyle {\mathsf {H_{2}CO_{3}+\ H_{2}O\rightleftarrows HCO_{3}^{-}+\ H_{3}O^{+}}}}, константа кислотности при 25 °C Ka1=[HCO3−]⋅[h4O+][h3CO3]=2,5⋅10−4{\displaystyle K_{a1}={\frac {\mathsf {[HCO_{3}^{-}]\cdot [H_{3}O^{+}]}}{\mathsf {[H_{2}CO_{3}]}}}=2,5\cdot 10^{-4}}
Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
- Ka′=[HCO3−]⋅[h4O+][CO2⋅h3O]=4,27⋅10−7{\displaystyle K_{a}’={\frac {\mathsf {[HCO_{3}^{-}]\cdot [H_{3}O^{+}]}}{\mathsf {[CO_{2}\cdot H_{2}O]}}}=4,27\cdot 10^{-7}}
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции
- HCO3−+ h3O⇄CO32−+ h4O+{\displaystyle {\mathsf {HCO_{3}^{-}+\ H_{2}O\rightleftarrows CO_{3}^{2-}+\ H_{3}O^{+}}}}, константа кислотности при 25 °C Ka2=[CO32−]⋅[h4O+][HCO3−]=4,68⋅10−11{\displaystyle K_{a2}={\frac {\mathsf {[CO_{3}^{2-}]\cdot [H_{3}O^{+}]}}{\mathsf {[HCO_{3}^{-}]}}}=4,68\cdot 10^{-11}}
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
- CO2⇄h3OCO2⋅h3O⇄h3CO3⇄−H+HCO3−⇄−H+CO32−(∗){\displaystyle {\mathsf {CO_{2}{\stackrel {H_{2}O}{\rightleftarrows }}CO_{2}\cdot H_{2}O\rightleftarrows H_{2}CO_{3}{\stackrel {-H^{+}}{\rightleftarrows }}HCO_{3}^{-}{\stackrel {-H^{+}}{\rightleftarrows }}CO_{3}^{2-}(*)}}}
Значение водородного показателя pH в такой системе, соответствующего насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:
- pH≈−12lg(Ka′⋅L)=3,9{\displaystyle {\mathsf {pH}}\approx -{\frac {1}{2}}\lg(K_{a}’\cdot L)=3,9}, где L = 0,034 моль/л — растворимость CO2 в воде при указанных условиях.
Разложение[править | править код]
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие смещается в сторону разложения угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
- h3CO3⟶h3O+CO2↑{\displaystyle {\mathsf {H_{2}CO_{3}\longrightarrow H_{2}O+CO_{2}\uparrow }}}
Взаимодействие с основаниями и солями[править | править код]
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
- h3CO3+2NaOH{\displaystyle {\mathsf {H_{2}CO_{3}+2NaOH}}}(конц.)⟶Na2CO3+2h3O{\displaystyle {\mathsf {\longrightarrow Na_{2}CO_{3}+2H_{2}O}}}
- h3CO3+NaOH{\displaystyle {\mathsf {H_{2}CO_{3}+NaOH}}}(разб.)⟶NaHCO3+h3O{\displaystyle {\mathsf {\longrightarrow NaHCO_{3}+H_{2}O}}}
- h3CO3+ Ca(OH)2⟶CaCO3↓+ 2h3O{\displaystyle {\mathsf {H_{2}CO_{3}+\ Ca(OH)_{2}\longrightarrow CaCO_{3}\downarrow +\ 2H_{2}O}}}
- h3CO3+ Nh4⋅h3O⟶Nh5HCO3+h3O{\displaystyle {\mathsf {H_{2}CO_{3}+\ NH_{3}\cdot H_{2}O\longrightarrow NH_{4}HCO_{3}+H_{2}O}}}
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
- h3CO3+Na2CO3⟶2NaHCO3{\displaystyle {\mathsf {H_{2}CO_{3}+Na_{2}CO_{3}\longrightarrow 2NaHCO_{3}}}}
- h3CO3+ CaCO3⟶Ca(HCO3)2{\displaystyle {\mathsf {H_{2}CO_{3}+\ CaCO_{3}\longrightarrow Ca(HCO_{3})_{2}}}}
Угольная кислота образуется при растворении в воде диоксида углерода:
- CO2+h3O⇄CO2⋅h3O⇄h3CO3{\displaystyle {\mathsf {CO_{2}+H_{2}O\rightleftarrows CO_{2}\cdot H_{2}O\rightleftarrows H_{2}CO_{3}}}}
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
- Na2CO3+2HCl⟶2NaCl+h3CO3{\displaystyle {\mathsf {Na_{2}CO_{3}+2HCl\longrightarrow 2NaCl+H_{2}CO_{3}}}}
- h3CO3→h3O+CO2↑{\displaystyle {\mathsf {H_{2}CO_{3}\rightarrow H_{2}O+CO_{2}\uparrow }}}
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. Газированная вода).
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора. Также применяется для производства хладагента, солнечных генераторов и морозильников.
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот[3].
Некоторые представители подобных соединений перечислены в таблице.
- ↑ 1 2 3 В водном растворе бо́льшая часть угольной кислоты обратимо переходит в гидрат диоксида углерода по реакции H2CO3 ⇄ CO2·H2O
- ↑ International first: Gas-phase carbonic acid isolated
- ↑ Нейланд О. Я. Органическая химия. — М.: Высшая школа, 1990. — С. 640—652. — 751 с. — ISBN 5-06-001471-1.
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2.
- Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5.
Теллуроводород — Википедия
| Теллуроводород | |||
|---|---|---|---|
| |||
| Традиционные названия | гидрид теллура, теллурид водорода, дигидрид теллура, дигидротеллурид | ||
| Хим. формула | H2Te | ||
| Состояние | газ | ||
| Молярная масса | 129,6159 г/моль | ||
| Плотность | 3,310 г/см³ | ||
| Температура | |||
| • плавления | −49 °C | ||
| • кипения | −2,2 °C | ||
| Энтальпия | |||
| • образования | 99,60 кДж/моль | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 2,6 | ||
| Растворимость | |||
| • в воде | 0,7 г/100 мл | ||
| • в этаноле | растворим | ||
| Рег. номер CAS | 7783-09-7 | ||
| PubChem | 21765 | ||
| Рег. номер EINECS | 231-981-5 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 49907 | ||
| ChemSpider | 20455 | ||
| Пиктограммы ECB |    | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Теллуроводоро́д (теллуран) — бинарное неорганическое соединение водорода и теллура с формулой H2Te. Представляет собой при нормальных условиях бесцветный, горючий, легкоразлагающийся газ с весьма неприятным запахом (напоминает чесночный запах арсина). Очень ядовит.
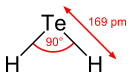
Молекула H2Те подобна молекуле сероводорода, имеет «изогнутую» структуру H-Те-H с углом между атомами водорода 89,5° и с расстоянием между атомами H и Te 0,169 нм.
Химические свойства теллуроводорода схожи со свойствами сероводорода, но в водных растворах H2Te более диссоциирован.
H2Те, как и селеноводород является очень сильным восстановителем, например, обесцвечивает раствор иода:
- h3Te+I2→2HI↑+Te{\displaystyle {\mathsf {H_{2}Te+I_{2}\rightarrow 2HI\uparrow +Te}}}
H2Те очень нестойкое соединение, уже при 0 °C в темноте медленно разлагается на элементы, при освещении скорость разложения нарастает (фотодиссоциация). Жидкий H2Те на свету разлагается очень быстро, именно от этого он на свету весьма быстро приобретает зеленовато-жёлтый цвет из-за растворения в нём элементарного теллура:
- h3Te→Te+h3↑{\displaystyle {\mathsf {H_{2}Te\rightarrow Te+H_{2}\uparrow }}}
Теллуроводород горит в воздухе или кислороде синим пламенем, с образованием диоксида теллура и воды:
- 2h3Te+3O2→2h3O+2TeO2{\displaystyle {\mathsf {2H_{2}Te+3O_{2}\rightarrow 2H_{2}O+2TeO_{2}}}}
Окисляется кислородом воздуха, особенно во влажном воздухе, до элементарного теллура даже при 0 °C:
- 2h3Te+O2→2Te+2h3O{\displaystyle {\mathsf {2H_{2}Te+O_{2}\rightarrow 2Te+2H_{2}O}}}
Для получения H2Те практически непригодны реакции взаимодействия теллуридов с водой или кислотами, так как из-за разложения образующегося H2Те его выход очень мал.
- Al2Te3+6HCl→3h3Te↑+2AlCl3{\displaystyle {\mathsf {Al_{2}Te_{3}+6HCl\rightarrow 3H_{2}Te\uparrow +2AlCl_{3}}}}
Поэтому используется электролитический метод с применением теллурового катода, платинового анода и серной (или ортофосфорной) кислот в качестве электролита при плотности тока несколько А/дм2 Процесс ведут при температуре около или немного ниже 0 °C.
Очистка[править | править код]
Выходящий из электролизёра газ (смесь H2Те, водорода, азота и водяного пара) предварительно глубоко осушают, пропуская последовательно через 2 колонки, наполненные плавленым хлоридом кальция и пентоксидом фосфора, затем, для отделения водорода и азота, газ пускают в приёмник, охлаждаемый жидким азотом или твердой углекислотой, где H2Те кристаллизуется. Процесс ведут в темноте или при очень слабом освещении.
Хранение[править | править код]
В твердом состоянии, при температуре жидкого азота. При этом H2Те разлагается очень медленно.
Предосторожности[править | править код]
Ввиду чрезвычайно высокой токсичности все работы с применением H2Те ведут в вытяжных шкафах.
Раствор H2Те в воде называют теллуроводородной кислотой. Её соли называют теллуридами. Как правило, эти соли — устойчивые соединения. Практически все теллуриды плохо растворимы в воде и окрашены в чёрный либо серый цвет. Исключение составляют теллуриды щелочных металлов и аммония, а также теллурид бериллия — бесцветные гигроскопические кристаллы, образующие кристаллогидраты. Растворы теллуридов в результате гидролиза имеют щелочную реакцию.
Пример реакции, не имеющей практического значения из-за трудности получения H2Те:
- CaO+h3Te→CaTe+h3O{\displaystyle {\mathsf {CaO+H_{2}Te\rightarrow CaTe+H_{2}O}}}
Поэтому теллуриды получают, как правило, прямым синтезом из элементов:
- 2K+Te→K2Te{\displaystyle {\mathsf {2K+Te\rightarrow K_{2}Te}}}
Так как H2Те — двухосновная кислота, можно было бы ожидать существование наряду со средними кислых солей, например как у селенидов, однако гидротеллуриды неизвестны.
Многие теллуриды металлов, особенно II группы таблицы Менделеева, обладают полезными термоэлектрическими, полупроводниковыми и фотополупроводниковыми свойствами.
H2Те применяется в электронной технологии для получения тончайших плёнок металлического теллура на различных подложках в процессах разложения или окисления: (1), (2). Также применяется для легирования из газовой фазы арсенида галлия, придавая ему электронный тип проводимости.
Теллуроводород очень токсичен, является гемолитическим ядом. Вдыхание теллуроводорода вызывает головную боль, тошноту и общую слабость; в дальнейшем присоединяются нарушения дыхания и кровообращения.
1-й класс опасности по ГОСТ 12.1.007-76.
- Гринвуд Н., Эрншо А. «Химия элементов». — Т.1. — М.: БИНОМ. Лаборатория знаний, 2008 стр. 56
- Гринвуд Н., Эрншо А. «Химия элементов». — Т.2. — М.: БИНОМ. Лаборатория знаний, 2008 стр. 117
- Некрасов Б. В. «Основы общей химии». — Т.1. — М.: Химия, 1973 стр. 352
- Рабинович В. А., Хавин З. Я. «Краткий химический справочник». — Л.: Химия, 1977 стр. 104
- Gal, J.-F.; Maria, P.-C.; Decouzon, M., The Gas-Phase Acidity and Bond Dissociation Energies of Hydrogen Telluride, Int. J. Mass Spectrom. Ion Proc., 1989, 93, 87.
- Новый справочник химика и технолога. Основные свойства неорганических, органических и элементорганических соединений / Редкол.: Скворцов Н. К. и др.. — СПб.: АНО НПО «Мир и семья», 2002. — 1280 с.


 (
(
 (
(