Что такое ревалентность
Вы слышали когда-нибудь о релевантности? А о релевантности запросу? — не отчаивайтесь — я сам ознакомился с этим термином пару лет назад, т.е. ни в школе, ни в университете, о том что такое релевантность мне не рассказали. А между тем… Между тем слово это прям-таки родное для каждого веб-промоутера. Веб промоутер может забыть как его зовут и текущую дату, но что такое релевантность, знать он просто обязан. Итак релевантность это: (здесь и далее цитирую источник, который достаточно компетентен в вопросах релевантности, а именно Яндекс.
«При поиске в Интернет важны две составляющие — полнота (ничего не потеряно) и точность (не найдено ничего лишнего). Обычно это все называют одним словом — релевантность , то есть соответствие ответа вопросу.» Грубо говоря, вы вводите в поисковой машине фразу, например «работа за границей» и в списке сайтов, выданных вам поисковиком видите странице посвященные именно работе за границей — сие есть высокая релевантность ответа запросу. Если же вы видите список сайтов, посвященных выращиванию кукурузы, в ответ на «работа за границей» — то релевантность низка до безобразия ну, на самом деле, такое вряд ли случится.
Ну а мы то здесь причем? — спросите вы. Ооооо! Очень даже причем. Хотите, чтобы чтобы ваш сайт находился в первой тридцатке, двадцатке, десятке и т.д. сайтов выдаваемых поисковой машиной? А как вы думаете поисковик определяет порядок следования сайтов в списке? Правильно! Он пытается выдать сайты, содержащие информацию, наиболее релевантную запросу! Маленькое отступление — тут есть некий неочевидный момент: между поисковыми машинами идет конкуренция, причем достаточно жесткая. И конечно, все они страются оптимизировать поисковые алгоритмы таким образом, чтобы выдавать наиболее релевантные запросам ответы. Более подробно об этих алгоритмах определения релевантности вы можете узнать на наиболее толковом в рунете сайте посвященном поисковым машинам.
Ну так вот — если вы хотите иметь реально работающий сайт — вы должны: определить какие именно слова и фразы в строке поиска будет задавать ваш потенциальный клиент (ежели оный сподобится искать нужную фирму в интернете) создать сайт так, чтобы поисковая машина сочла его содержание наиболее релевантным ответом на фразу, заданную пользователем. Как это сделать? Это тема для отдельной статьи. Так или иначе, самое лучшее, что вы можете сделать — это поставить себя на место посетителя вашего сайта, и посмотреть — какую именно информацию вы хотели бы на нем видеть. Вот в общем-то и все о релевантности. Надеюсь, что эта статья была релевантна вашему запросу (если вы конечно набрали в поисковике слово «релевантность» :-)))
Напоминаю всем, у кого возникают странные вопросы: понятие ревалентность=релевантность. Так уж повелось среди web-мастеров 🙂 Ничего поделать с этим не смогли.
Валентность — Википедия
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число химических связей.
История возникновения понятия «валентность»[править | править код]
Этимологию термина валентность возможно отследить начиная с 1425 года, когда его начали использовать в научных текстах в значении «экстракт», «препарат». Использование в рамках современного определения зафиксировано в 1884 году (нем. Valenz)[1]. В 1789 году Уильям Хиггинс опубликовал работу, в которой высказал предположение о существовании связей между мельчайшими частицами вещества[2].

Однако точное и позже полностью подтверждённое понимание феномена валентности было предложено в 1852 году химиком Эдуардом Франклендом в работе, в которой он собрал и переосмыслил все существовавшие на тот момент теории и предположения на этот счёт[3]. Наблюдая способность к насыщению разных металлов и сравнивая состав органических производных металлов с составом неорганических соединений, Франкленд ввёл понятие о « соединительной силе» (соединительном весе), положив этим основание учению о валентности. Хотя Франкленд и установил некоторые частные закономерности, его идеи не получили развития.
Решающую роль в создании теории валентности сыграл Фридрих Август Кекуле. В 1857 году он показал, что углерод является четырёхосновным (четырёхатомным) элементом, и его простейшим соединением является метан СН4. Уверенный в истинности своих представлений о валентности атомов, Кекуле ввёл их в свой учебник органической химии: основность, по мнению автора — фундаментальное свойство атома, свойство такое же постоянное и неизменяемое, как и атомный вес. В 1858 году взгляды, почти совпадающие с идеями Кекуле, высказал в статье «О новой химической теории» Арчибальд Скотт Купер.
Уже три года спустя, в сентябре 1861-го, А. М. Бутлеров внёс в теорию валентности важнейшие дополнения. Он провёл чёткое различие между свободным атомом и атомом, вступившим в соединение с другим, когда его сродство «
Огромным достоинством теории валентности явилась возможность наглядного изображения молекулы. В 1860-х годах появились первые молекулярные модели. Уже в 1864 году А. Браун предложил использовать структурные формулы в виде окружностей с помещёнными в них символами элементов, соединённых линиями, обозначающими химическую связь между атомами; количество линий соответствовало валентности атома. В 1865 году А. фон Гофман продемонстрировал первые шаростержневые модели, в которых роль атомов играли крокетные шары. В 1866 году в учебнике Кекуле появились рисунки стереохимических моделей, в которых атом углерода имел тетраэдрическую конфигурацию.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода — двум, азота — трём, углерода — четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K
У большинства элементов значения валентности в водородных и в кислородных соединениях различны: например, валентность серы по водороду равна двум (H2S), а по кислороду шести (SO3). Кроме того, большинство элементов проявляют в разных своих соединениях различную валентность [некоторые элементы могут не иметь ни гидридов, ни оксидов]. Наприм., углерод образует с кислородом два оксида: монооксид углерода CO и диоксид углерода CO2. В монооксиде углерода валентность углерода равна двум, а в диоксиде — четырём (некоторые элементы способны образовывать также пероксиды). Из рассмотренных примеров следует, что охарактеризовать валентность элемента каким-нибудь одним числом и/или методом, как правило, нельзя.
Современные представления о валентности[править | править код]
С момента возникновения теории химической связи понятие «валентность» претерпело существенную эволюцию. В настоящее время оно не имеет строгого научного толкования, поэтому практически полностью вытеснено из научной лексики и используется, преимущественно, в методических целях.
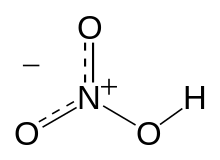 Резонансная модель образования ковалентных связей в молекуле HNO3
Резонансная модель образования ковалентных связей в молекуле HNO3В основном, под валентностью химических элементов обычно понимается способность свободных его атомов (в более узком смысле — мера его способности) к образованию определённого числа ковалентных связей
Число связей, которые может образовывать атом, равно числу его неспаренных электронов, идущих на образование общих электронных пар (молекулярных двухэлектронных облаков). Ковалентная связь может образовываться также по донорно-акцепторному механизму. При этом в обоих случаях не учитывается полярность образовавшихся связей, а потому валентность не имеет знака — она не может быть ни положительной, ни отрицательной, в отличие от степени окисления (N2, NO2, NH3 и [NH4]+).
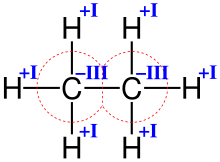 Структурная формула молекулы этана
Структурная формула молекулы этанаКроме валентности по водороду и по кислороду, способность атомов данного элемента соединяться друг с другом или с атомами других элементов в ряде случаев можно выразить [часто и отождествить] иными способами: как, например, степень окисления элемента (условный заряд атома в предположении, что вещество состоит из ионов), ковалентность (число химических связей, образуемых атомом данного элемента, в том числе и с одноимённым элементом; см. ниже), координационное число атома (число атомов, непосредственно окружающих данный атом) и т. п. Эти характеристики могут быть близки и даже совпадать количественно, но ни коим образом не тождественны друг другу
Особенно это справедливо для молекул с делокализованными химическими связями, например в азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4. Известное из многих школьных учебников правило — «Максимальная валентность элемента численно равна номеру группы в Периодической таблице» — относится исключительно к степени окисления. Понятия «постоянной валентности» и «переменной валентности» также преимущественно относятся к степени окисления.
Семиполярные и донорно-акцепторные (дативные) связи по своей сути являются «двойными» связями, поскольку при их образовании происходят оба процесса: перенос электрона (образование ионной связи) и обобществление электронов (образование ковалентной связи).
Понятие валентности нельзя использовать и в очень многих случаях, когда невозможно применить модель двухэлектронных двухцентровых связей[6] — нельзя говорить о валентности элементов в соединениях, где отсутствуют ковалентные связи (чаще в таких случаях корректнее говорить о степени окисления). Представления о валентности не применимы для описания кластерных соединений, бороводородов, карборанов, π-комплексов, соединений благородных газов и многих других. Например, катионы щелочных металлов в комплексах с краун-эфирами проявляют валентность, намного превышающую их степень окисления.
Некорректным будет использование валентности для описания соединений с ионной кристаллической структурой. Так в кристалле хлорида натрия NaCl у каждого иона Na+ или Cl− — центра элементарной ячейки — реальное число соседних ионов — координационное число — равно 6, а степень окисления — +1 и −1 соответственно. Локализованных же электронных пар вовсе нет.
В современной химии активно используется метод молекулярных орбиталей, в котором отсутствуют какие-либо аналоги понятия валентности атома. Между тем, понятие кратности химической связи наиболее близко к характеристике числа образуемых связей. Отождествление единичной связи с двухэлектронной молекулярной орбиталью возможно лишь в предельном, локализованном случае[5]. В квантовой химии аналога понятия валентности как характеристики атома в молекуле не существует, а используемое понятие спин-валентности относится к изолированному атому[7].
Ковалентность элемента (мера валентных возможностей элементов; ёмкость насыщения) определяется общим числом неспаренных электронов [валентных электронных пар[8]] как в нормальном, так и в возбуждённом состоянии атома, или, иначе говоря, число образуемых атомом ковалентных связей (углерод 2s22p2 II-ковалентен, а в возбуждённом состоянии C* 2s12p3 — IV-ковалентный; таким образом в CO и CO2 валентность составляет II или IV, а ковалентность — II и/или IV). Так, ковалентность азота в молекулах N2, NH3, Al≡N и цианамиде Ca=N-C≡N равна трём, ковалентность кислорода в молекулах H2O и CO2 — двум, ковалентность углерода в молекулах CH4, CO2 и кристалле C (алмаза) — четырём.
В классическом и/или пост-квантовохимическом представлении по электронным спектрам поглощения двухатомных молекул можно определять число оптических (валентных) электронов при данной энергии возбуждения[9]. Согласно этому методу, обратная величина тангенса угла наклона корреляционной прямой/прямых (при релевантных значениях молекулярных электронных термов, которые образованы относительными суммами атомных) соответствует числу пар валентных электронов, то есть валентности в её классическом понимании[10].
Между валентностью [стехиометрической] в данном соединении, мольной массой его атомов и его эквивалентной массой существует простое соотношение, непосредственно вытекающее из атомной теории и определения понятия «эквивалентная масса».
Стехиометрическая валентность [расчётная] элемента в данном соединении[11] равна молекулярной массе его атомов (в г/моль), делённой на эквивалентную массу элемента (в г/моль):
- V=ME{\displaystyle V={\frac {M}{E}}}
V — Стехиометрическая валентность
M — Молекулярная масса (г/моль)
E — Эквивалентная масса (г/моль)
Так, стехиометрическая валентность углерода в CO 12 (г/моль) /6 (г/моль) = 2, а в CO2 12 /3 = 4.
В неорганической химии во многих случаях понятие валентности элемента теряет определённость: эта величина зависит от знания химического строения соединения, во многих случаях она может быть больше номера группы (таблицы ПСХЭ). В неорганической химии обычно применяется понятие степень окисления, а в органической химии — валентность, так как большинство неорганических веществ имеет немолекулярное строение, а органических — молекулярное. Нельзя отождествлять эти два понятия, даже если они численно совпадают. Широко применяется также термин «валентные электроны», то есть наиболее слабо связанные с ядром атома, чаще всего внешние электроны.
По валентности элементов можно составлять истинные формулы соединений, и, наоборот, исходя из истинных формул можно определять валентности элементов в данных соединениях. При этом необходимо придерживаться принципа, согласно которому произведение валентности одного элемента на число его атомов равно произведению валентности второго элемента на число его атомов. Так, чтобы составить формулу оксида азота (III), следует записать сверху над символом валентности элементов NIII{\displaystyle {\stackrel {III}{\mbox{N}}}} OII{\displaystyle {\stackrel {II}{\mbox{O}}}}. Определив наименьший общий знаменатель и разделив его на соответствующие валентности, получим атомное соотношение азота к кислороду, а именно 2 : 3. Следовательно, формула оксида азота (III) соответствует N+32O−23{\displaystyle {\stackrel {+3}{\mbox{N}}}_{2}{\stackrel {-2}{\mbox{O}}}_{3}}. Для определения валентности поступают таким же образом наоборот.
- ↑ Valence — Online Etymology Dictionary.
- ↑ Partington, J.R. A Short History of Chemistry (неопр.). — Dover Publications, Inc, 1989. — ISBN 0-486-65977-1.
- ↑ Frankland E. On a New Series of Organic Bodies Containing Metals. // Phil. Trans. 1852. Vol. 142. P. 417—444.
- ↑ Неорганическая химия / Б. Д. Степин, А. А. Цветков ; Под ред. Б. Д. Степина. — М.: Высш. шк., 1994. — С. 71—72
- ↑ 1 2 Валентность атомов в молекулах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — С. 126
- ↑ Развитие учения о валентности. Под ред. Кузнецова В. И. М.: Химия, 1977. стр.19.
- ↑ Татевский В. М. Квантовая механика и теория строения молекул. М.: Изд-во МГУ, 1965. Глава 3.
- ↑ в том числе в донорно-акцепторной связи
- ↑ Серов Н. В. Электронные термы простых молекул // Оптика и спектроскопия, 1984, Т.56, вып.3, с. 390—406.
- ↑ Ionov S.P. and Kuznetsov N.T. Excited and Ionized and States of h3 in Terms of the Structural Thermodynamic Model// Russian Journal of Inorganic Chemistry Vol. 50, No. 2, February 2005, pp. 233—237
- ↑ В предположении что Валентность неизвестна, но известны молекулярная масса и эквивалентная масса соединения.
- Л. Паулинг Природа химической связи. М., Л.: Гос. НТИ хим. литературы, 1947.
- Картмелл, Фоулс. Валентность и строение молекул. М.: Химия, 1979. 360 с.]
- Коулсон Ч. Валентность. М.: Мир, 1965.
- Маррел Дж., Кеттл С., Теддер Дж. Теория валентности. Пер. с англ. М.: Мир. 1968. (недоступная ссылка)
- Развитие учения о валентности. Под ред. Кузнецова В. И. М.: Химия, 1977. 248с.
- Валентность атомов в молекулах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — С. 126.
Теория ожиданий — Википедия
Теория ожиданий (англ. Expectancy theory) была изложена канадским психологом Виктором Врумом в 1964-м году в работе «Труд и мотивация»[1]. Согласно теории, уровень мотивации сотрудников зависит от их представлений относительно своих способностей к выполнению тех или иных рабочих задач и получению вознаграждения. Данная теория утверждает, что людей мотивирует к работе ожидание того, что выбранный ими тип поведения действительно приведёт их к желаемому результату.
В теории выделяют три основных момента мотивации человека:[2]
- ожидание
- содействие
- валентность[3]
Ожидание[править | править код]
Согласно теории, ожидание является представлением человека о том, что затраченные им усилия приведут к ожидаемому и желаемому результату
Содействие[править | править код]
Врум писал о том, что под содействием понимается надежда человека на вознаграждение в зависимости от результатов.
Валентность[править | править код]
Валентность представляет собой предполагаемую степень относительного удовлетворения или неудовлетворения, которая возникает вследствие получения определенного вознаграждения.
Мотивация, согласно теории, является составляющей функцией всех трех компонентов. Из этого следует, что она будет высокой тогда, когда все составляющие высоки. В случае, если один из этих трех компонентов равен нулю, общий уровень мотивации будет также равен нулю. Если рабочий верит, что его усилия приведут к результату, который будет вознагражден, мотивация будет отсутствовать, если валентность ожидаемого вознаграждения равна нулю.
В то же самое время, мотивация не равноценна результатам работы. Данная теория признает, что мотивация является одним из нескольких важных параметров, определяющих результат. В частности, теория предполагает, что навыки и способности вносят большой вклад в итог трудовой деятельности: некоторые люди более приспособлены к работе, чем другие, благодаря присущим им индивидуальным чертам, умениям и талантам.
Восприятие роли человеком также влияет на результат работы. До тех пор, пока есть разногласия в определении служебных обязанностей, может страдать производительность.
Применение принципов теории ожидания в практике управления[править | править код]
Теория ожиданий имеет несколько важных приложений к практике повышения мотивации служащих компании:[2]
- Усилия людей приводят к ожидаемому результату
- Положительный эффект вознаграждения служащих
- Связь величины награждения и производительности
Усилия людей приводят к ожидаемому результату[править | править код]
Мотивация может усилиться посредством обучения персонала работать более эффективно, из чего, следовательно, повысится и уровень производства. Также возможно увеличить производительность, следуя предложениям служащих о путях изменения условий работы. До той степени, пока они представляют проблемы на своей работе, связанные с производительностью труда, попытки руководства преодолеть эти трудности могут помочь им работать более эффективно.
Положительный эффект вознаграждения служащих[править | править код]
Другими словами для появления мотивации должно быть соответствующее вознаграждение. Предполагать в настоящее время, что каждый сотрудник желает получить одинаковое вознаграждение было бы ошибкой: некоторые мечтают о повышении заработной платы, другие — дополнительные выходные дни, полноценную страховку, социальное и пенсионное обеспечение. Принимая это во внимание, многие компании предлагают план вознаграждения по принципу «кафетерия»[4] то есть системе, которая позволяет самому сотруднику выбрать схему своего вознаграждения из списка взаимоисключающих возможностей.
Связь величины награждения и производительности[править | править код]
Иначе говоря, менеджеры должны точно определить: какое поведение приведет к каким конкретным вознаграждениям. Теория ожиданий отмечает, что довольно эффективно выплачивать рабочим вознаграждения, непосредственно связанные с результатом их работы
Теория ожиданий стала предметом критики таких исследователей, как Г.Граэн (1969), Э.Лоулер (1971) и Л.Портер[5] (1967 и 1968). Данная критика скорее является расширением к идеям Врума, нежели отклонением от них. Сам Врум признал факт того, что его теорию следовало обновить, используя новые данные.[6]
Одним из основных критических замечаний теории является простота теории, в том смысле, что она не объясняет разные уровни усилий, предпринимаемых человеком. Кроме того, существует предположение о том, что вознаграждение будет побуждать сотрудника принимать больше усилий, чтобы получить данное вознаграждение, но игнорирует факт того, что рассматриваемая награда может иметь отрицательные последствия для человека. Например, из-за повышения заработной платы данный сотрудник может попасть в более высокую налоговую категорию.[7]
В 1995 г. Виктором Врумом было предложено несколько идей для преобразования своей теории. Эти предложения были направлениями для создания «современной теории ожиданий», которая соответствовала бы последним научным изысканиям. Среди этих предложений можно выделить следующие:
- Ситуационная теория
- Включение механизмов возникновения мотивов
- Более пристальное изучение внутренней мотивации
Ситуационная теория[править | править код]
Согласно данной теории, уровень восприятия альтернатив не будет фиксированным (в отличие от первоначальной теории ожиданий), а будет варьироваться. На одном конце может быть поведение, находящееся под влиянием сильных эмоций или привычек, где действия во многом не зависят от целей и информации. На другом конце могут быть достаточно простые проблемы выбора, в которых альтернативы ясны и вся информация о них доступна. В этом случае уровень восприятия информации индивидом приближается к тому, который представляется теорией ожиданий. Хотя, безусловно, этот уровень будет зависеть от ограничивающих факторов и отклонений, установленных сторонниками теории перспективы.
Включение механизмов возникновения мотивов[править | править код]
Валентность и выгодность не имеют одинаковых свойств. Валентность результатов зависит от ситуации. Включение в теорию механизмов, связывающих валентность и факторы окружающей среды, обстановки, может приблизить данную теорию к исследованиям в области постановки целей.
Более пристальное изучение внутренней мотивации[править | править код]
Валентность результата, такая, как успешное выполнение задачи или работы, рассматривается в теории ожиданий как величина, зависящая от представлений об обстоятельствах достижения других результатов (таких как более высокая зарплата или самооценка) и значимости этих результатов. Различают внутреннюю мотивацию, в которой валентность результатов зависит от процессов, влияющих изнутри, и внешнюю мотивацию, в которой валентность результатов можно свести к ожидаемым действиям других и поощрениям и наказаниям того, что не подконтрольно.
В 1970-х годах, будучи небольшим семейным предприятием, владелец «Solar Press» Джон Хадец ежемесячно выписывал работникам премии в $ 20-60. Все получали одну и ту же сумму не понимая, за что.[8]
Для того, чтобы работники четко осознавали связь размеров бонусов с достигнутыми показателями производительности, менеджментом компании было принято решение разделить сотрудников на команды. Каждая из них получала ежемесячные бонусы, размер которых определялся достигнутыми ими результатами. Производительность труда возросла, но вскоре конкуренция между командами приобрела негативный характер, так как вместо того, чтобы следить за состоянием оборудования, сотрудники были озабочены не столько своими показателями, сколько результатами других команд, так как отставание означало потерю премии. В конце концов, соревнование между командами создало больше проблем, чем разрешило.
Экологическая валентность — Википедия
Материал из Википедии — свободной энциклопедии
Экологическая валентность[1][2][3][4][5], или экологическая пласти́чность, или экологическая толерантность — способность организма существовать в определённом диапазоне значений экологического фактора. Сам этот диапазон также называют экологической амплитудой[4][6][7]. Пластичность определяется нормой реакции.
Для обозначения широты диапазона экологической валентности по отношению к отдельным факторам используют приставки эври- «широкий» и стено- «узкий». Виды с широкой валентностью называют эврибионтами. Они имеют возможность заселять местообитания с различными условиями. Виды живущие в узком диапазоне действия факторов называют стенобионтами. Способность их к освоению местообитаний значительно ограничена[1][3].
| Фактор | Широкая валентность | Узкая валентность |
|---|---|---|
| Температура | Эвритерм | Этенотерм |
| Влажность | Эвригигробионт | Этеногигробионт |
| Глубина | Эврибат | Стенобат |
| Соленость | Эвригал | Стеногал |
| Пища | Эвритроф | Стенотроф |
| Освещённость | Эврифот | Стенофот |
| Кислотность | Эвриоксибионт | Стенооксибионт |
Следует помнить, что вид может быть, например, стенобионтом по одному фактору и эврибионтом — по другому и наоборот. Например, человек является эврибионтом по отношению к температуре воздуха, но стенобионтом по содержанию кислорода в нём.
- ↑ 1 2 Чернова Н.М., Былова А.М. Общая экология. Учебник. — М.: Дрофа, 2004.
- ↑ Белошапкин и др. Словарь-справочник энтомолога. — М.: Нива России, 1992. — С. 40—41. — 334 с. — ISBN 5-260-00498-1.
- ↑ 1 2 Биологический энциклопедический словарь / Гл. ред. М. С. Гиляров; Редкол.: А. А. Баев, Г. Г. Винберг, Г. А. Заварзин и др. — М.: Сов. энциклопедия, 1986. — С. 729. — 831 с. — 100 000 экз.
- ↑ 1 2 Словарь ботанических терминов / И.А. Дудка. — Киев: Наукова Думка, 1984.
- ↑ Реймерс, 1991, с. 83.
- ↑ Зданович В.В., Криксунов Е.А. Гидробиология и общая экология: словарь терминов. — М., 2004.
- ↑ Реймерс, 1991, с. 30.
- ↑ Реймерс, 1991, с. 418—420.
- ↑ Реймерс, 1991, с. 494—494.
ВАЛЕНТНОСТЬ — это… Что такое ВАЛЕНТНОСТЬ?
ВАЛЕНТНОСТЬ — (от лат. valere иметь значение), или атомность, число атомов водорода или эквивалентных ему атомов или радикалов, к рое может присоединить данный атом или радикал. В. является одной из основ распределения элементов в периодической системе Д. И.… … Большая медицинская энциклопедия
Валентность — * валентнасць * valence термин происходит от лат. имеющий силу. 1. В химии это способность атомов химических элементов образовывать определенное число химических связей с атомами др. элементов. В свете строения атома В. это способность атомов… … Генетика. Энциклопедический словарь
ВАЛЕНТНОСТЬ — (от лат. valentia сила) в физике число, показывающее, со сколькими атомами водорода может соединяться данный атом или замещать их. В психологии валентность есть идущее из Англии обозначение для побуждающей способности. Философский… … Философская энциклопедия
валентность — атомность Словарь русских синонимов. валентность сущ., кол во синонимов: 1 • атомность (1) Словарь синонимов ASIS. В.Н. Тришин … Словарь синонимов
ВАЛЕНТНОСТЬ — (от лат. valentia – крепкий, прочный, влиятельный). Способность слова к грамматическому сочетанию с другими словами в предложении (например, у глаголов валентность определяет способность сочетаться с подлежащим, прямым или косвенным дополнением) … Новый словарь методических терминов и понятий (теория и практика обучения языкам)
ВАЛЕНТНОСТЬ — (от латинского valentia сила), способность атома химического элемента присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи … Современная энциклопедия
ВАЛЕНТНОСТЬ — (от лат. valentia сила) способность атома химического элемента (или атомной группы) образовывать определенное число химических связей с другими атомами (или атомными группами). Вместо валентности часто пользуются более узкими понятиями, напр.… … Большой Энциклопедический словарь
ВАЛЕНТНОСТЬ — ВАЛЕНТНОСТЬ, валентности, мн. нет, жен. (от лат. valens имеющий ценность, значение) (хим.). То же, что атомность. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ВАЛЕНТНОСТЬ — ВАЛЕНТНОСТЬ, и, жен. (спец.). Способность атома (или атомной группы) образовывать химические связи с другими атомами (или атомными группами). | прил. валентный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ВАЛЕНТНОСТЬ — (от лат. valentia сила), способность атомов элементов к образованию химических связей; количественно характеризуется числом. В. можно рассматривать как способность атома отдавать или присоединять определ. число эл нов внеш. электронных оболочек… … Физическая энциклопедия
Обсуждение:Валентность — Википедия
Постоянная валентность С, Si — 4.
СО2 — углекислый газ СО — угарный газ Валентность С — 2,4, значит переменная.
88.215.143.190 06:50, 6 февраля 2011 (UTC)
Нашел ошибку в статье «Валентность»
- Переменная валентность:
* Cu, Hg — 1 и 2 . * Fe, Co, Ni — 2 и 3. * Sn, Pb — 2 и 4 . * P — 3 и 5. * Cr — 2, 3 и 6. * S — 2, 4 и 6. * Mn — 2, 3, 4, 5 и 7. * N — 2, 3, 4, 5. * Cl — 1, 3, 5, 7.
Максимальная валентность азота равна четырем и никак не может достигать 5. Скорее всего, автор перепутал понятия «валентность» и «степень окисления» — Эта реплика добавлена с IP 188.186.148.164 (о)
Перенесено со страницы ВП:СОО. —IGW 07:07, 24 января 2011 (UTC)таблица валентности элементов[править код]
сделайте кто-нибудь таблицы элементов с валентностью или список.—Kaiyr 16:56, 19 февраля 2012 (UTC)
- Зачем? Для многих элементов представления о валентности вообще не применимы или требуют отдельного рассмотрения (см. статью). Если же речь о «школьной» валентности (составление формул соединений), то вернее говорить о степени окисления.—AlmaPater44 18:15, 19 февраля 2012 (UTC)
В статье слишком «опускается» понятие валентности. Которое ну никак не исчезло из научного лексикона , что дает элементарный поиск например, по журналу Inorganic Chemistry. Да исследования по валентности редки, но это не означает ее исчезновения. Также как теория относительности вовсе не отменила классическую мезанику. Химия просто немыслима без этого понятия, хотя оно и не универсально и не совсем точно определено. Очень много практически важных задач решаются не ее основе. Кантово-химический снобизм совершенно неуместен. Простейшие задачи, легко решаемые на основе представлений о валентноси, недоступны квантовой химии в обозримом будущем. ««
Статья нуждается в серьезной переработке. Автор проявляет редкостное упрямство в своей личной трактовке положения дел в химии, упорно «опуская» понятие валентности, и достаточно произвольно толкуя его соотношение со степенью окисления. Автор произвольно выдумывает факты — что якобы понятие валентности в современной научной литературе неупотребимо. И скрывает то, что его точка зрения не всеми разделяется. . Раздел «современные представления о валентности» — содержат не взвешенное мнение о том, что представления о валентности не везде применимы, а совершенно оголтелое отрицание валентности. Что никак нельзя назвать научным подходом. Статья фактически — пропаганда ЛИЧНЫХ взглядов автора, а не объективное изложение вопроса. Что никак нельзя признать нормальным. В таком виде статью лучше всего вообще УДАЛИТЬ, ибо я уже сталкивался с человеком, которому запудрили мозги этой статьей. . Печально то, что не сказав ничего по существу вопроса, автор просто удалил мое дополнение с обоснованием сохранения понятия валентности. . Это не научный подход, а НАВЯЗЫВАНИЕ своего мнения. Диоген««
- Не я отменял ваши правки. Но поскольку камушек запущен, очевидно, в мой огород, считаю нужным ответить. Первое. Валентность из химии никто не изгонял, однако нелепо отрицать, что современные представления о химической связи на нём давно не основываются. Только для малой части молекулярных структур (не говоря уже о кристаллических и иных) позволительно использовать модель двухэлектронной двухцентровой связи (а это краеугольный камень валентности). Именно эти простейшие молекулы — предмет изучения в начальном курсе химии, и именно поэтому здесь сохраняются представления о валектности как о способности (в т.ч. количественной харатеристике) атомов элементов образовывать ковалентные связи. Но даже простые структуры с пи-связями типа азотной кислоты, диоксида серы или бензола приходится описывать в МВС как совокупность локализованных структур. Однако, т.н. «исключения» давно стали «правилом.» Второе. Указанные соображения не являются плодом моих фантазий или личных взглядов (хотя, пожалуй, трудно отрицать последнее), а основываются на конкретных изданиях, включенных в пристатейный список и примечания. В статье достаточно чётко проводится мысль о границах употребления понятия, а вовсе не его отрицание. Третье. Автор имеет химическое образование «выше высшего», преподает неорганическую химию и искренне не понимает обвинений в «физическом снобизме». Четвертое. Дополнения и исправления — право любого и основа ВП, но они не должны быть тенденциозны и беспочвенны. С ув. —AlmaPater44 19:45, 23 марта 2012 (UTC)
Спасибо за ответ. Но просто сравнив по объему изложение понятия валентности и критику этого понятия — видно, что статью следовало бы озаглавить «критика традицоннных представлений о валентности». Для сравнения загляните на английскую страничку википедии со статьей valency. Акцент следовало бы сделать на понятии валентность и на его плюсах, а не скатываться в сплошную критику. Утверждение, что азот бывает только четырехвалентным — плод попыток «примирить» традиционные понятия о валентности с квантово-механическими представлениями. Что на мой взгляд — примерно как скрестить ежа и ужа. «совокупность локализованных структур» — именно отсюда и вылезает. Куда разумнее — оставить кесарю — кесарево и не пытаться скрещивать далекие виды. И химия не сводится только к теоретическим исследованиям природы связей. Вот там — соглашусь, понятие о валентности -устарело (точнее, показало свою отнюдь не универсальность). Для множества других химических задач это понятие вполне полезно и практично. И имеет отнюдь не чисто методическое значение. Ну, например, структуру соединений C3H8 или Hg2Br2 я сходу запишу без всяких квантово-химических расчетов. Собственно именно об этом было мое дополнение, которое неизвестно кто удалил без всякой мотивировки. Ну а что касается образования — то я «бульдозерист с 4 классами» и меня ниститутами не запугаешь!
- -)
Диоген««
- Я не понимаю, к чему настойчиво упоминать «квантово-механические представления». Разумеется, современная трактовка валентности на них основывается, поскольку представления об обменном двухээлектронном механизме — суть метода валентных схем (связей). Никакого скрещения ужа и ежа тут нет: это просто вытекает одно из другого. Равно как четырехвалентность азота вытекает из электронной конфигурации. Но давайте поймем — валентность просто удобное представление, у которого, как вы правильно отмечаете, есть, по сути, одно применение — составление структурных формул простейших соединений. И всё! Это и есть «традиционные» представления, корни которых уходят в 1920-1930-е гг. —AlmaPater44 18:00, 24 марта 2012 (UTC)
Применение вовсе не одно. Вы забываете, что химия — наука по большей части отнюдь не чисто теоретическая и ее задачи — никак не сводятся к моделированию природы химических связей. Есть море прикладных задач, решать которые с точки зрения теории МО было бы просто идиотизмом. В каком соотношениее надо брать реагенты, что и в каком количестве будет получаться. А молекулярные орбитали, гибридизация итп — это тоже некоторые прелставления отнбдь не бесспорные и не универсальные. Строго говоря, следует проводить квантовомеханический расчет без всяких подобных предположений. Но он реально возможен только в самых простейших случаях, вроде молекулы водорода. Что касается азота, то меня всегда удивляло упроство в объвлении его 4-валентным. Ибо что это дает практически? — А ничего вообще! Только подгонку под определенные электронные прелставления. Ни один технолог не рискнет рассчитывать производство азотной кислоты, исходя из 4-хвалентности азота. Это и есть попытка скрестить ежа и ужа. В соответствии с традиционными представлениями азот — 5-валентен. Что отлично подходит для практики. А 4-валентность — это уже выход ЗА традиционные представления. Ну а если вернуться к нашим баранам, то есть статье, то вторую часть по содержанию — следовало озаглавить — «современные представления о химической связи» и вынести в отдельную статью. И дать на нее отсылку. тем болеее, что там никаких «современных представлений о валентности», кроме разнообразного «охаивания» ее, нет. Да посмотрите сами — по объему критика валентности занимает не меньше, чем изложение ее. Само изложение куцее, и весьма малоинформативное. Создается впечатление, что статья написана только затем, чтобы покритиковать валентность, а не для того , чтобы доступно и подробно ее изложить. Разумеется, упомянув о ее ограниченности и не универсальности. Но развернутую критику и изложение современных теорий — вынести в отдельную статью. . Достоинство традиционных представлений о валентности — их простота и практичность. А универсальных теорий вообще нет. Кроме прямого квантового расчета. Но он настолько сложен, что нечего и думать…Да и метод МО далеко не прост. Диоген««
- Столько слов написано! Но к чему и о чём?! Не возьму в толк, каким образом «технолог использует пятивалентность азота при расчётах? Это делается по уравнениям реакций, для составления которых структурные представления обычно не важны. Не нравится «охаивание» (где его сыскали?) — возьмите и дополните статью, как считаете нужным! Только не декларативными, бездоказательными утверждениями (именно они, как я понял, и были удалены), а основанными на АИ (весьма желательно современными учебниками по неорг. химии). —AlmaPater44 11:38, 25 марта 2012 (UTC)
- Нынешнее представление связи и валентности связи вполне можно объяснить доступно без замысловатых МВС и ММО, не доступных познанию обычному школьнику и учащемуся техникума/колледжа (последние дебри — МВС & ММО — и не каждому студенту ВУЗов ясны)… —De Riban5 07:49, 29 апреля 2014 (UTC)
Человек писавший статью не знаком со степенью окисления[править код]
Да и по-видимому с валентностью тоже не сильно. Не буду править но вкратце отмечу:
1 Валентность это просто химическая связь. Когда мы говорим о валентности элемента мы говорим о практической способности его образовывать некие связи (без учета координационных), причем не уточняем тип связи. Мы говорим что углерод четырех и двухвалентен, натрий одновалентен и т.д. И тут не имеет значения тип связи. Напр. азот в азотной кислоте пятивалентен, однако у него всего 4 ковалентных связи и 5-я ионная. Именно так исторически и появилась валентность — химики начали понимать что элементы образуют некие связи, пока без уточнения их типов. Напр. стало понятно что есть 5-и и 4-х валентный азот; позже, в 20-м веке, стало понятно что азот может образовывать лишь 4 ковалентных связи а 5-я какая-то иная. Подробное изучение молекулы и свойств азотной кислоты подтвердили что 5-я связь ионная. Как часто водится из фразы выпал кусок и оказалось что азот может быть «лишь 4-х валентным», что является полнейшей глупостью. На этом примере, я считаю, отлично показано понятие валентности и его применение.
2 Степень окисления — величина абсолютно формальная. И уж никаким образом с номером группы элемента не сочитается. СО может быть принятой абсолютно любой, хоть +100, она нужна лишь для расчетов ОВР, причем расчет сойдется вне зависимости от принятой величины СО если остальные правила расчета будут соблюдены.
3 Автор писавший статью путает степень окисления с зарядом иона (!) т.е. валентностью в случае ионной связи.
4 Номер группы элемента показывает лишь число электронов на внешнем электронном уровне элемента со всеми вытекающими. Это не максимально возможная валентность (напр. медь двухвалентная хотя в 1-й группе, у фтора невозможно оторвать электроны химическим путем хотя он в 7-й группе и т.д.) и уж точно не максимально возможный заряд иона или СО. Это лишь число электронов, но не более того, оно может указывать на максимально возможную валентность а может и нет. Слово «указывать» тут ключевое.
5 Согласно описанной процедуре составления формул, «истинную формулу» (а такого понятия нет т.к. получается есть еще и ложные — о ужас во лжи мы все живем, нужно срочно открыть людям правду!) перекиси водорода составить нельзя или непонятно какая валентность у элементов в ней. Однако, если мы говорим о валентности как о химической связи в общем смысле, то все становится на свои места — раз водород одновалентный а кислород двух, то собрать валентности в формулу Н-О-О-Н не представляет труда.
Тенденциозность автора[править код]
Автор, по-видимому, является приверженцем одного из современных течений, пытающихся всё объяснить с точки зрения квантовой теории. Но при этом само поведение электронов в атоме воспринимается утрированно, на самом же деле реальные электроны ведут себя гораздо сложнее, чем это пытаются представить, рисуя различные орбитали. Это довольно абстрактная вещь, и при описании химических процессов следует избегать чрезмерного крена в сторону квантовой теории. Конкретно касаясь валентности, не стоит путать божий дар с яичницей. Это формальный термин, и служит исключительно для понимания химических формул. И есть определение IUPAC, которое автором игнорируется — это к вопросу о тенденциозности. Есть формальный принцип: у водорода валентность 1, у кислорода — 2. Из этого и исходим. Хотите объяснять, почему у одних элементов такая валентность, а у других другая — используйте теорию строения атома, флаг Вам в руки. Но не коверкайте при этом формализованные понятия, имеющие совершенно конкретное предназначение. Не надо нести такую чушь, что у азота в азотной кислоте валентность 4, а не 5 (и да, из этого ведь автоматом следует, что у кислорода она не 2 — а 1,5). Статья однозначно вредная, как и лекции и учебники с аналогичным содержанием. Такие вещи надо оставлять для любителей альтернативной науки, а не преподносить как истину в первой инстанции. И не забивать мозг школьникам и студентам. Полезнее было бы просто перевести на русский язык вариант статьи из английской версии.
Валентность — это… Что такое Валентность?
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.
История возникновения понятия «валентность»
Этимологию термина валентность возможно отследить начиная с 1425 года, когда его начали использовать в научных текстах в значении «экстракт», «препарат». Использование в рамках современного определения зафиксировано в 1884 году (нем. Valenz).[1] В 1789 году Уильям Хиггинс опубликовал работу, в которой высказал предположение о существовании связей между мельчайшими частицами вещества.[2]
Однако точное и позже полностью подтверждённое понимание феномена валентности было предложено в 1852 году химиком Эдуардом Франклендом в работе, в которой он собрал и переосмыслил все существовавшие на тот момент теории и предположения на этот счёт.[3]. Наблюдая способность к насыщению разных металлов и сравнивая состав органических производных металлов с составом неорганических соединений, Франкленд ввёл понятие о «соединительной силе», положив этим основание учению о валентности. Хотя Франкленд и установил некоторые частные закономерности, его идеи не получили развития.
Решающую роль в создании теории валентности сыграл Фридрих Август Кекуле. В 1857 г. он показал, что углерод является четырёхосновным (четырёхатомным) элементом, и его простейшим соединением является метан СН4. Уверенный в истинности своих представлений о валентности атомов, Кекуле ввёл их в свой учебник органической химии: основность, по мнению автора — фундаментальное свойство атома, свойство такое же постоянное и неизменяемое, как и атомный вес. В 1858 г. взгляды, почти совпадающие с идеями Кекуле, высказал в статье «О новой химической теории» Арчибальд Скотт Купер.
Уже три года спустя, в сентябре 1861 г. А. М. Бутлеров внёс в теорию валентности важнейшие дополнения. Он провёл чёткое различие между свободным атомом и атомом, вступившим в соединение с другим, когда его сродство «связывается и переходит в новую форму». Бутлеров ввёл представление о полноте использования сил сродства и о «напряжении сродства», то есть энергетической неэквивалентности связей, которая обусловлена взаимным влиянием атомов в молекуле. В результате этого взаимного влияния атомы в зависимости от их структурного окружения приобретают различное «химическое значение». Теория Бутлерова позволила дать объяснение многим экспериментальным фактам, касавшимся изомерии органических соединений и их реакционной способности.
Огромным достоинством теории валентности явилась возможность наглядного изображения молекулы. В 1860-х гг. появились первые молекулярные модели. Уже в 1864 г. А. Браун предложил использовать структурные формулы в виде окружностей с помещёнными в них символами элементов, соединённых линиями, обозначающими химическую связь между атомами; количество линий соответствовало валентности атома. В 1865 г. А. фон Гофман продемонстрировал первые шаростержневые модели, в которых роль атомов играли крокетные шары. В 1866 г. в учебнике Кекуле появились рисунки стереохимических моделей, в которых атом углерода имел тетраэдрическую конфигурацию.
Современные представления о валентности
С момента возникновения теории химической связи понятие «валентность» претерпело существенную эволюцию. В настоящее время оно не имеет строгого научного толкования, поэтому практически полностью вытеснено из научной лексики и используется, преимущественно, в методических целях.
Резонансная модель образования ковалентных связей в молекуле HNO3В основном, под валентностью химических элементов понимается способность свободных его атомов к образованию определённого числа ковалентных связей. В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся двухэлектронных двухцентровых связей. Именно такой подход принят в теории локализованных валентных связей, предложенной в 1927 году В. Гайтлером и Ф. Лондоном в 1927 г. Очевидно, что если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами[4]. При оценке максимальной валентности следует исходить из электронной конфигурации гипотетического, т. н. «возбуждённого» (валентного) состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH)42-, BF4— и NH4+), фосфора — 5 (PCl5), серы — 6 (H2SO4), хлора — 7 (Cl2O7).
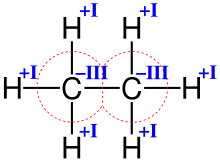 Структурная формула молекулы этана
Структурная формула молекулы этанаВ ряде случаев, с валентностью отождествляются такие характеристики молекулярной системы как степень окисления элемента, эффективный заряд на атоме, координационное число атома и т. д. Эти характеристики могут быть близки и даже совпадать количественно, но ни коим образом не тождественны друг другу[5]. Например, в изоэлектронных молекулах азота N2, монооксида углерода CO и цианид-ионе CN— реализуется тройная связь (то есть валентность каждого атома равна 3), однако степень окисления элементов равна, соответственно, 0, +2, −2, +2 и −3. В молекуле этана (см. рис.) углерод четырёхвалентен, как и в большинстве органических соединений, тогда как степень окисления формально равна −3.
Особенно это справедливо для молекул с делокализованными химическими связями, например в азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4. Известное из многих школьных учебников правило — «Максимальная валентность элемента численно равна номеру группы в Периодической таблице» — относится исключительно к степени окисления. Понятия «постоянной валентности» и «переменной валентности» также преимущественно относятся к степени окисления.
Семиполярные и донорно-акцепторные (дативные) связи по своей сути являются «двойными» связями, поскольку при их образовании происходят оба процесса: перенос электрона (образование ионной связи) и обобществление электронов (образование ковалентной связи).
Понятие валентности нельзя использовать и в очень многих случаях, когда невозможно применить модель двухэлектронных двухцентровых связей[6]. Представления о валентности не применимы к описанию кластерным соединениям, бороводородам, карборанам, π-комплексам, соединениям благородных газов и многим другим. Например, катионы щелочных металлов в комплексах с краун-эфирами проявляют валентность, намного превышающую их степень окисления.
Некорректным будет использование валентности для описания соединений ионной, кристаллической природы. Так в кристалле хлорида натрия NaCl у каждого иона Na+ или Cl— — центра элементарной ячейки — реальное число соседних ионов координационное число равно 6, а степень окисления — +1 и −1 соответственно. Локализованных же электронных пар вовсе нет.
В современной химии активно используется метод молекулярных орбиталей, в котором отсутствуют какие-либо аналоги понятия валентности атома. Между тем, понятие кратности химической связи наиболее близко к характеристике числа образуемых связей. Отождествление единичной связи с двухэлектронной молекулярной орбиталью возможно лишь в предельном, локализованном случае[5]. В квантовой химии аналога понятия валентности как характеристики атома в молекуле не существует, а используемое понятие спин-валентности относится к изолированному атому[7].
См. также
Примечания
- ↑ Valence — Online Etymology Dictionary.
- ↑ Partington J.R. A Short History of Chemistry. — Dover Publications, Inc, 1989. — ISBN 0-486-65977-1
- ↑ Frankland E. On a New Series of Organic Bodies Containing Metals. // Phil. Trans. 1852. Vol. 142. P. 417—444.
- ↑ Неорганическая химия / Б. Д. Степин, А. А. Цветков ; Под ред. Б. Д. Степина. — М.: Высш. шк., 1994. — С. 71—72
- ↑ 1 2 Валентность атомов в молекулах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — С. 126
- ↑ Развитие учения о валентности. Под ред. Кузнецова В. И. М.: Химия, 1977. стр.19.
- ↑ Татевский В. М. Квантовая механика и теория строения молекул. М.: Изд-во МГУ, 1965. Глава 3.
Ссылки
Литература
- Л. Паулинг Природа химической связи. М., Л.: Гос. НТИ хим. литературы, 1947.
- Картмелл, Фоулс. Валентность и строение молекул. М.: Химия, 1979. 360 с.]
- Коулсон Ч. Валентность. М.: Мир, 1965.
- Маррел Дж., Кеттл С., Теддер Дж. Теория валентности. Пер. с англ. М.: Мир. 1968.
- Развитие учения о валентности. Под ред. Кузнецова В. И. М.: Химия, 1977. 248с.
- Валентность атомов в молекулах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — С. 126.

