Акцептор (физика) — Википедия
Материал из Википедии — свободной энциклопедии
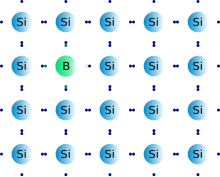 Схематическое изображение кремния с акцепторной примесью бора
Схематическое изображение кремния с акцепторной примесью бораАкце́птор — в физике твёрдого тела (также полупроводников) примесь в кристаллической решётке, которая придаёт кристаллу дырочный тип проводимости, при которой носителями заряда являются дырки. Термин имеет смысл при ковалентном типе связей в кристалле.
Акцепторы бывают однозарядными и многозарядными. Например, в кристаллах элементов IV группы периодической системы элементов (кремния, германия) элементы III группы (бор, алюминий, индий, галлий) являются однозарядными акцепторами. Поскольку элементы третьей группы имеют валентность 3, то три электрона его внешней электронной оболочки образуют химическую связь с тремя соседними атомами, например, кремния в кубической решётке, а электрона для образования четвёртой связи недостает. Однако при ненулевой температуре с определённой вероятностью четвёртая связь образуется за счет захвата недостающего 4-го электрона у атома кремния. При этом лишенный 4-го электрона атом кремния приобретает положительный заряд. Энергия захваченного акцептором электрона на несколько эВ выше энергии потолка валентной зоны. Из-за теплового движения электронов дырка может быть заполнена электроном, отнятым у соседнего атома кремния, при этом тот приобретёт положительный заряд — дырка переместится на этот атом кремния. Поэтому, можно считать, что носителями заряда являются перемещаемые положительно заряженные дырки. При приложении электрического поля дырки начнут упорядоченно двигаться к катоду. Естественно, истинными носителями заряда по-прежнему являются электроны.
Для оценки энергии связи дырок на акцепторах часто используют модель водородоподобного центра, в которой энергия связи находится из решения уравнения Шредингера для атома водорода с учётом того, что дырка в кристалле — квазичастица, эффективная масса которой отличается от массы свободного электрона, а также того, что дырка движется не в вакууме, а в среде с определённой диэлектрической проницаемостью. Такие акцепторы называются мелкими и образуют водородоподобную серию уровней с энергиями, которые можно оценить по формуле
- Ea=EV+Rmh∗m0ε21n2{\displaystyle E_{a}=E_{V}+R{\frac {m_{h}^{*}}{m_{0}\varepsilon ^{2}}}{\frac {1}{n^{2}}}},
где Ea{\displaystyle E_{a}} — энергия акцепторного уровня, EV{\displaystyle E_{V}} — энергия потолка валентной зоны, mh∗{\displaystyle m_{h}^{*}} — эффективная масса дырки, m0{\displaystyle m_{0}} — масса свободного электрона, ε{\displaystyle \varepsilon } — диэлектрическая проницаемость полупроводника, R{\displaystyle R} — постоянная Ридберга, n{\displaystyle n} — квантовое число, которое принимает значение от 1 до бесконечности (однако в основном важны только состояния с малыми числами n{\displaystyle n}).
Более строгий расчет энергии основного и возбуждённых состояний акцепторных уровней требует учёта локального потенциала примеси, а также наличия во многих полупроводниках нескольких ветвей у закона дисперсии дырок (лёгкие и тяжёлые дырки). Акцепторы, энергия связи которых близка к энергии, оценённой из водородоподобной модели, называются мелкими акцепторами.
Обычно эффективные массы дырок малы в сравнении с массой свободного электрона. Кроме того полупроводники имеют достаточно большие значения диэлектрической проницаемости (порядка 10), так что энергия акцептора примерно в 100—1000 раз меньше энергии электрона в атоме водорода. Именно благодаря этим особенностям акцепторные уровни во многих полупроводниках ионизованы уже при комнатной температуре. Учитывая этот факт, волновые функции мелких акцепторных уровней простираются на много периодов кристаллической решётки, имея радиус намного больше чем радиус Бора.
| Полупроводник | Акцептор | Ea−EV{\displaystyle E_{a}-E_{V}} (мэВ) |
|---|---|---|
| GaAs | C | 26 |
| Be | 28 | |
| Mg | 28 | |
| Si | 35 | |
| Si | B | 45 |
| Al | 67 | |
| Ga | 72 | |
| In | 160 | |
| Ge | B | 10 |
| Al | 10 | |
| Ga | 11 | |
| In | 11 |
- Ансельм А. И. Введение в теорию полупроводников. — 2-е изд., доп. и перераб.. — М.: Наука, 1978. — 615 с.
Донорно-акцепторный механизм — это что такое? :: SYL.ru
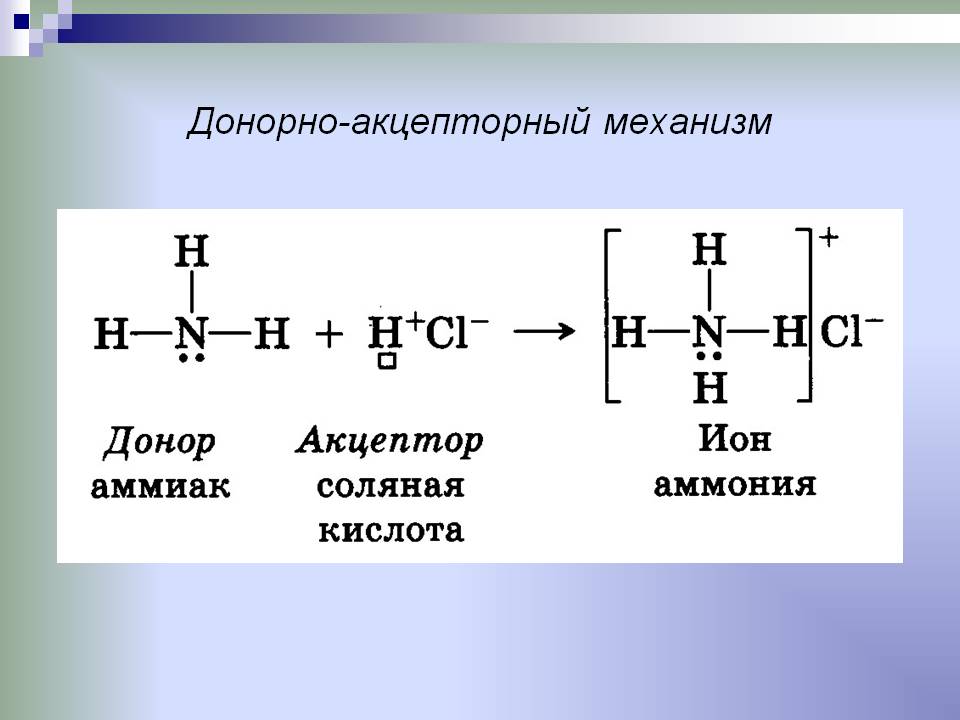
Донорно-акцепторный механизм образования химической связи предполагает перенос заряда между акцептором и донором без создания между ними общей химической связи. Также возможна передача неподеленной пары электронов к акцептору от донора, в результате образуется связь.
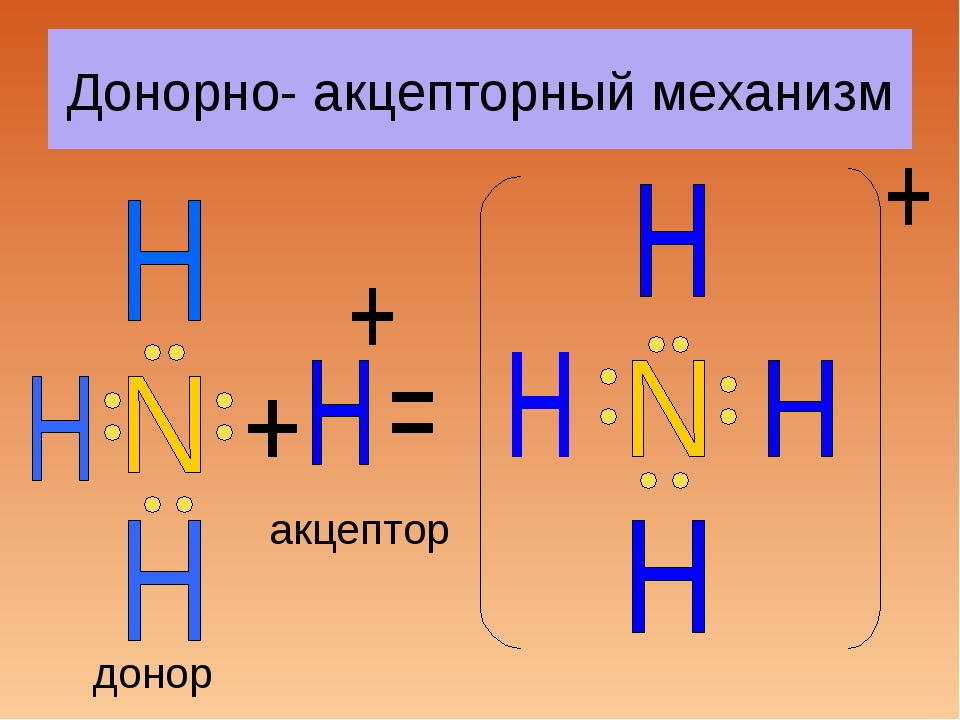
Образование солей аммония
Рассмотрим донорно-акцепторный механизм на примере солей аммония. Начнем со взаимодействия аммиака (Nh4) и трифторида бора (BF3). В процессе реакции происходит выделение 171,4 кДж/моль энергии. Взаимодействие протекает по уравнению:
NH3 + BF3 = NH3BF3
Из четырех орбиталей, имеющихся у атома бора, три заполнены электронами, следовательно, есть одна вакантная орбиталь. В молекуле аммиака четыре орбитали азота укомплектованы электронами, причем три из них по обменному механизму дополнены электронами водорода. Одна орбиталь имеет электронную пару, принадлежащую только атому азота. Ее называют неподеленной электронной парой. Именно благодаря ей возможен донорно-акцепторный механизм.
Соединение между аммиаком и трифторидом бора возможно благодаря тому, что вакантная электронная пара аммиака размещается на свободной орбитали фторида бора.
Это донорно-акцепторный механизм образования ковалентной связи. Атом азота увеличивает валентность благодаря использованию неподеленной пары электронов для дополнительной связи. Бор повышает валентность посредством расположения на орбитали дополнительных электронов.
Таким образом, валентность этих химических элементов характеризуется и неспаренными электронами, и неподеленными электронными парами, и свободными орбиталями на внешнем энергетическом уровне.
Определения
Донором в данном примере выступает атом азота, который отдает свою электронную пару на образование химической связи. Акцептором является бор, обладающий вакантной орбиталью, принимающий электронную пару.
Процесс сопровождается уменьшением потенциальной энергии данной системы, выделением эквивалентного количества энергии. Вопросы, касающиеся механизма образования данного вида ковалентной связи, включены в курс школьной программы по химии, они предлагаются в итоговых тестах выпускникам средней общеобразовательной школы.
Образование катиона аммония
Ковалентная связь, образованная по донорно акцепторному механизму, характерна для солей аммония. Остановимся подробнее на ее особенностях. Итак, именно по донорно-акцепторному механизму образована связь между атомами азота и водорода в реакции:
NH3 + H+= NH4+
В качестве акцептора выступает пустая орбиталь катиона водорода. Азот в катионе аммония проявляет валентность 4. Образование связи происходит и благодаря паре электронов, которые до начала взаимодействия принадлежали азоту.
Это связь ковалентная по донорно-акцепторному механизму. В итоге взаимодействия образуется катион аммония, который по ионному механизму будет объединяться с анионами, содержащимися в кислотах.

Образование угарного газа
Донорно-акцепторный механизм можно рассмотреть на примере молекулы СО. У атома углерода на внешнем энергетическом уровне располагаются два неспаренных электрона. Такое же количество неспаренных электронов есть и у атома кислорода. В результате между атомами образуется двойная связь.
За счет пары электронов кислорода и пустой орбитали углерода, для получения связи используется донорно-акцепторный механизм.
Молекула азотной кислоты
Благодаря наличию трех неспаренных электронов атом азота в данном соединении образует три варианта связей: с кислородом двойную, одинарную с кислородом гидроксильной группы. По донорно-акцепторному механизму образована связь между еще одним атомом кислорода и азота.
Неспаренные электроны размещаются на одной орбитали, при этом одна освобождается.
Также можно допустить, что атомом азота отдан кислороду электрон. Превратившись в катион аммония, имеющий 4 неспаренные электрона, он удерживает анион благодаря силам электростатического взаимодействия.
Свойства связи
В качестве донора выступают молекулы, в составе которых есть атомы N, O, F, Cl, связанные с атомами иных химических элементов. Акцептором выступает частица, имеющая вакантные электронные уровни. К примеру, это могут быть представители d-семейств, которые имеют незаполненные d-орбитали.
В молекуле аммиака для образования связи задействованы три неспаренных электрона атома азота, и по 1s-электрону у трех атомов водорода. Связи находятся вдоль трех осей р-орбиталей. Молекула имеет вариант правильной пирамиды, в углах которой располагаются атомы водорода, а в вершине — азот азота. Угол между связями составляет 107 градусов. Аналогичные по форме молекулы образуют с водородом следующие элементы: сурьма, мышьяк, фосфор.
Свойства ковалентной связи, которая образуется по донорно-акцепторному механизму, не отличаются от характеристик связи, сформированной по обменному механизму. В качестве доноров могут выступать атомы азота, серы, фосфора, кислорода, владеющие неподеленными электронными парами на валентных орбиталях небольшого размера.
Функцию акцептора выполняют катионы водорода, часть р-металлов, к примеру, алюминий, образуя ион AlH4—.
Также акцепторами выступают d-элементы, у которых есть незаполненная энергетическая ячейка во внешнем электронном слое.
Отметим, что на данный механизм образования связи распространяются все основные характеристики: насыщаемость, длина, кратность.
Особенности органических соединений
Взаимодействие по обменному механизму возможно для органических доноров. В частности, среди них можно отметить π-доноров, типичным примером которых является тетракис(диметиламино)этилене (ТДАЭ), органические акцепторы (фуллерены), хинодиметаны с акцепторными заместителями.
При химическом взаимодействии подобных соединений создается комплекс с переносом заряда. В нем заряженный положительно донор с отрицательно заряженным акцептором взаимодействуют благодаря силам электростатической природы. Значение имеют системы, в которых перенос заряда в основном электронном состоянии происходит частично, а в случае фото возбуждения наблюдается полная его передача.
Такие системы, донорно-акцепторные диады, триады, внутри которых между акцептором и донором есть мостиковая группа, позволяющая повышать длительность состояния с переносом электрического заряда, применяются для получения устройств, преобразующих солнечную энергию. Подобное явление, связанное с переносом заряда в любых его формах, применяется во многих биологических процессах.
Именно поэтому так подробно рассматриваются особенности протекания взаимодействий по донорно-акцепторному механизму в органических соединениях, анализируются возможности ускорения (замедления) подобных процессов, варианты введения дополнительных веществ (катализаторов).
Подведем некоторые итоги
Донорно-акцепторное взаимодействие является одним из важнейших проявлений ковалентной полярной химической связи. Ему уделяется существенное внимание в неорганической, аналитической, органической химии.
К примеру, именно с точки зрения донорно-акцепторного механизма поясняется образование ковалентных локализованных связей в молекулярных ионах координационных (комплексных) соединений. Связь в них создается благодаря неподеленной паре электронов лиганда и свободной орбитали комплексообразователя. Также донорно-акцепторный механизм поясняет формирование промежуточных продуктов. В частности, это создание комплексов с переносом заряда.
Существует модель донорно-акцепторного механизма лишь в рамках представлений о валентности как о возможности локализации плотности электронов в процессе формирования ковалентных связей. Именно этот механизм является основой образования разнообразных комплексных соединений. Такое взаимодействие необходимо для кислотно-основных превращений, касающихся переноса иона водорода (акцептора), образования наноструктур.
акцептор — Викисловарь
Морфологические и синтаксические свойства[править]
| падеж | ед. ч. | мн. ч. |
|---|---|---|
| Им. | акце́птор | акце́пторы |
| Р. | акце́птора | акце́пторов |
| Д. | акце́птору | акце́пторам |
| В. | акце́птор | акце́пторы |
| Тв. | акце́птором | акце́пторами |
| Пр. | акце́пторе | акце́пторах |
ак-це́п-тор
Существительное, неодушевлённое, мужской род, 2-е склонение (тип склонения 1a по классификации А. А. Зализняка).
Корень: -акцепт-; суффикс: -ор [Тихонов, 1996].
Произношение[править]
Семантические свойства[править]
Значение[править]
Общее прототипическое значение — объект, получающий (принимающий) что-либо от другого объекта, называемого донором.
- хим. вещество, присоединяющее к себе атом водорода (в окислительно-восстановительной реакции) ◆ Отсутствует пример употребления (см. рекомендации).
- физ. дефект кристаллической решётки полупроводника, в виде примесного атома, который может захватывать электроны из валентной зоны у доноров, образуя при этом дырки, участвующие в электропроводности ◆ Отсутствует пример употребления (см. рекомендации).
- мед. организм, которому пересаживают орган или ткань или переливают кровь ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
- реципиент
Антонимы[править]
- конверсив: донор
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
Этимология[править]
Происходит от лат. acceptor «получатель», из гл. acceptāre, усилит. гл. к accipere «принимать, получать», из ad «к, на» + capere «брать; получать» (восходит к праиндоевр. *kap- «хватать»).
Фразеологизмы и устойчивые сочетания[править]
Перевод[править]
Библиография[править]
Донорно-акцепторная связь
Возможен и другой механизм образования ковалентной связи – донорно-акцепторный. В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого атома. Рассмотрим в качестве примера механизм образования иона аммония (NH4+). В молекуле аммиака атом азота имеет неподеленную пару электронов (двухэлектронное облако)
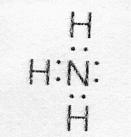
У иона водорода свободна (не запонена) 1s-орбиталь, что можно обозначить как Н+ (здесь квадрат означает ячейку). При образовании иона аммония двухэлектронное облако азота становится общим для атомов азота и водорода, то есть оно превращается в молекулярное электронное облако. А значит, возникает четвертая ковалентная связь. Процесс образования иона аммония можно представить схемой
Заряд иона водорода становится общим (он делокализован, т.е. рассредоточен между всеми атомами), а двухэлектронное облако (неподеленная электронная пара), принадлежащая азоту, становится общей с Н+. В схемах изображение ячейки часто опускается.
Атом, предоставляющий неподеленную электронную пару, называется донором, а атом, принимающий ее (то есть предоставляющий свободную орбиталь), называется акцептором.
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным. Образованная таким путем ковалентная связь называется донорно-акцепторной или координационной связью.
Однако это не особый вид связи, а лишь иной механизм (способ) образования ковалентной связи. По свойствам четвертная связь N-H в ионе аммония ничем не отличается от остальных трех.
Большей частью донорами являются молекулы, содержащие атомы N, O, F, Cl связанные в ней с атомами других элементов. Акцептором может быть частица, обладающая вакантными электронными уровнями, например, атомы d-элементов, обладающие незаполненными d-подуровнями.
Свойства ковалентной связи
Длина
связи –
это межъядерное расстояние. Химическая
связь тем прочнее, чем меньше ее длина.
Длина связи в молекулах составляет:
НС3-СН3 1,54
1,33 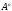 ;
НС≡СН 1,20
;
НС≡СН 1,20  .В
пересчете на одинарные связи эти величины
увеличиваются, реакционная способность
соединений с кратными связями возрастает.
Мерой прочности связи является энергия
связи.
.В
пересчете на одинарные связи эти величины
увеличиваются, реакционная способность
соединений с кратными связями возрастает.
Мерой прочности связи является энергия
связи.
Энергия связи определяется количеством энергии, которое необходимо для разрыва связи. Обычно она измеряется в килоджоулях, отнесенных к 1 молю вещества. С увеличением кратности связи энергия связи увеличивается, а ее длина уменьшается. Величины энергии связи в соединениях (алканы, алкены, алкины): С-С 344 кДж/моль; С=С 615 кДж/моль; С≡С 812 кДж/моль. То есть энергия двойной связи меньше удвоенной энергии одинарной связи, а энергия тройной связи меньше утроенной энергии одинарной связи, поэтому алкины более реакционноспособны из этой группы углеводородов.
Под насыщаемостью понимают способность атомов образовывать ограниченное число ковалентных связей. Например, атом водорода (один неспаренный электрон) образует одну связь, атом углерода (четыре неспаренных электрона в возбужденном состоянии) – не более четырех связей. Вследствие насыщаемости связей молекулы имеют определенный состав: Н2, СН4, НСl и т.д. Однако и при насыщенных ковалентных связях могут образовываться более сложные молекулы по донорно-акцепторному механизму.
Направленность ковалентной связи обусловливает пространственную структуру молекул, то есть их форму. Рассмотрим это на примере образования молекул HCl, H2O, NH3.
Согласно МВС, что ковалентная связь возникает в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов. При образовании молекулы НСl происходит перекрывание s-орбитали атома водорода с р-орбиталью атома хлора. Молекулы такого типа имеют линейную форму.
На внешнем уровне атома кислорода имеются два неспаренных электрона. Орбитали их взаимно перпедикулярны, т.е. располагаются относительно друг друга под углом 90о. При образовании молекулы воды орбиталь каждого р-электрона перекрывается 1s-орбиталью атома водорода вдоль линии осей координат. Химические связи в этом случае должны быть направлены под углом 90о. Экспериментально найдено, что угол между связями в молекуле воды ے Н-О-Н = 104,5о, что объясняется частичной sр3-гибридизацией атомных орбиталей кислорода.
Таким образом, атом кислорода с двумя неспаренными (валентными) р-элект-ронами образует с водородом молекулы воды, которая имеет угловую форму. Очевидно, молекулы такой же формы должны образовывать с водородом аналоги кислорода – сера, селен, теллур.
В образовании молекулы NH 3 участвуют три неспаренных р-электрона атома азота, электронные орбитали которых также взаимно перпендикулярны, и 1s-электроны трех атомов водорода.
Связи располагаются вдоль трех осей р-орбиталей. Молекула имеет форму правильной пирамиды, в углах треугольника находится атомы водорода, в вершине пирамиды – атом азота. Угол между связями ے Н-N-Н = 107,3о. Молекулы такой же формы (но с другим значением угла) образуют с водородом аналоги азота – фосфор, мышьяк, сурьма.

Образование молекул NH3 и Н2О
примеры. Что такое донорно-акцепторный механизм?
Химической связью называется связь двух и более атомов (молекул) в органическом или неорганическом соединении. Она образуется при условии уменьшения общей энергии в системе.
Все ли элементы могут образовывать химические связи
Все элементы периодической системы имеют разную способность к образованию связи. Наиболее устойчивыми и, как результат, химически малоактивными являются атомы благородных (инертных) газов, так как содержат на внешней электронной оболочке два или восемь электронов. Они образуют небольшое количество связей. К примеру, неон, гелий и аргон не образуют химических связей ни с одним элементом, тогда как ксенон, криптон и радон способны реагировать с фтором и молекулами воды.
У атомов других элементов внешние уровни не завершены и имеют от одного до семи электронов, поэтому для повышения устойчивости оболочки образуют химические связи.
Типы химической связи
Выделяют несколько типов связи:
- Ковалентная.
- Ионная.
- Металлическая.
- Водородная.
Ковалентная связь
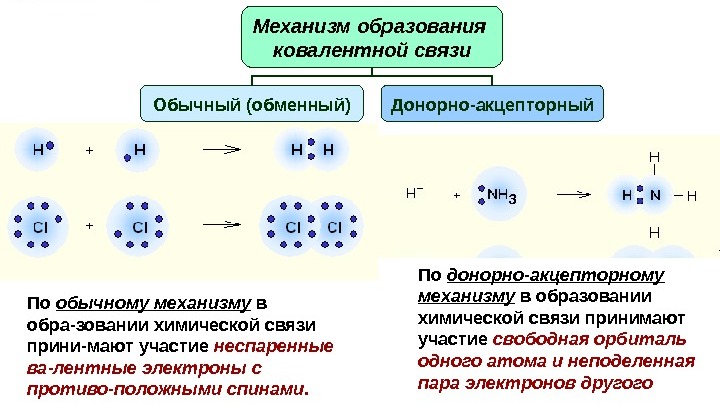
Данный тип связи формируется между атомами в молекуле в результате обобществления или перекрытия валентной электронной пары. Соответственно, существует обменный (а) и донорно-акцепторный (б) механизмы образования ковалентной связи. Отдельным случаем является дативная связь, которая будет рассмотрена ниже.
Ковалентная связь: обменный механизм
У атомов на внешнем уровне есть неспаренные электроны. При взаимодействии внешние оболочки перекрываются. Антипараллельные спины одиночных электронов, содержащихся на внешних уровнях, спариваются с образованием электронной пары, общей для обоих атомов. Данная пара электронов представляет, собственно, ковалентную связь, которая образована по обменному механизму, к примеру, в молекуле водорода.
Ковалентная связь: донорно-акцепторный механизм
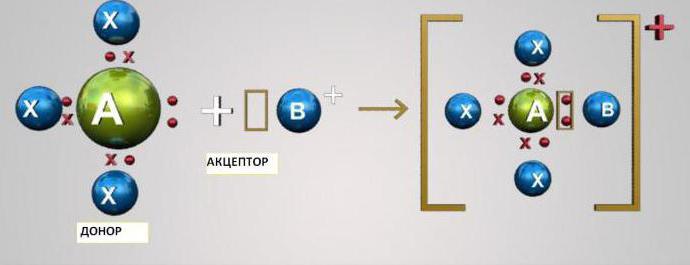
Данный механизм заключается в обобществлении двумя атомами двух находящихся на внешнем уровне электронов. При этом один из атомов выступает в качестве донора (предоставляет два электрона), а другой — акцептора (имеет вакантную орбиталь для электронов). Атомы s- и p-элементов могут быть либо акцепторами, либо донорами электронов. Атомы d-элементов способны быть и донорами, и акцепторами.
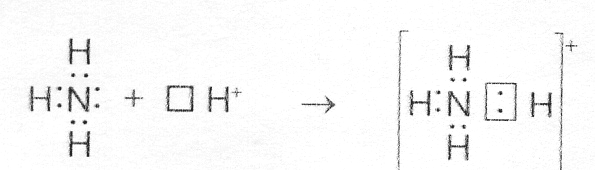
Чтобы понять, что такое донорно-акцепторный механизм, рассмотрим два простейших примера — образование катионов гидроксония H3O+ и аммония NH4+.
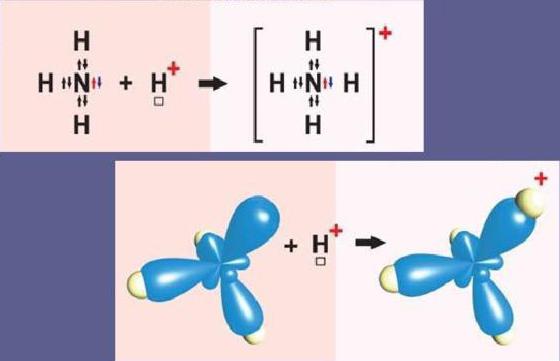
Пример донорно-акцепторного механизма — катион аммония
Схематически реакция образования частицы аммония выглядит следующим образом:
NH3+H+=NH4+
Электроны в атоме N распределены в следующем порядке: 1s2 2s2 2p3.
Электронная структура катиона H: 1s0.
Атом азота на внешнем уровне содержит два s- и три p-электрона. Три p-электрона участвуют в образовании трех ковалентных обменного типа связей азот-водород N-H. В результате этого образуется молекула аммиака NH3 с ковалентным типом связи. Поскольку атом азота N на внешнем уровне имеет еще пару электронов s, молекула NH3 может присоединить еще и катион водорода. Молекула аммиака является донором, а катион водорода H+ – акцептором, который принимает донорские электроны от азота на собственную свободную s-орбиталь.
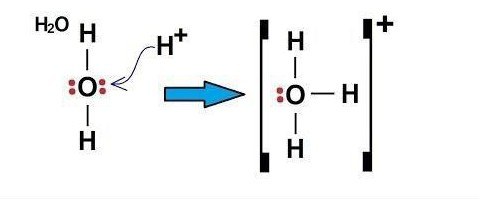
Пример донорно-акцепторного механизма – h4O (ион гидроксония)
Электроны в атоме кислорода распределены в следующем порядке: 1s2 2s2 2p4.
Атом кислорода на внешнем уровне имеет два s и четыре p-электрона. Исходя из этого, в образовании связей H-O принимают участие два свободных p-электрона и два s-электрона от двух атомов H. То есть 2 имеющиеся связи в молекуле H2O – ковалентные, образованные по обменному механизму.
Электронная структура катиона водорода: 1s0.
Так как у атома кислорода на внешнем уровне остались еще два электрона (s-типа), он может образовать третью связь ковалентного типа по донорно-акцепторному механизму. Акцептором может быть атом, имеющий свободную орбиталь, в данном примере это частица H+. Свободную s-орбиталь катиона H+ занимают два электрона (s) атома кислорода.
Донорно-акцепторный механизм образования ковалентной связи между неорганическими молекулами
Донорно-акцепторный механизм ковалентной связи возможен не только во взаимодействиях типа «атом-атом» или «молекула-атом», но и в реакциях, протекающих между молекулами. Единственным условием для донорно-акцепторного взаимодействия кинетически независимых молекул является уменьшение энтропии, другими словами, повышение упорядоченности химической структуры.
Рассмотрим первый пример — образование апротонной кислоты (кислоты Льюиса) NH3BF3. Данный неорганический комплекс образуется в реакции присоединения молекулы аммиака и фторида бора.
NH3+BF3= NH3BF3
Электроны в атоме бора распределены в следующем порядке: 1s2 2s2 2p1.
При возбуждении атома B один электрон s-типа переходит на p-подуровень (1s2 2s1 2p2). Таким образом, на внешнем уровне возбужденного атома бора находится два s- и два p-электрона.
В молекуле BF3 три ковалентные связи бор-фтор B-F образованы обменного типа (атомы бора и фтора предоставляют по одному электрону). После образования трех ковалентных связей у атома бора на внешней электронной оболочке остается свободный p-подуровень, за счет которого молекула фторида бора может выступать акцептором электронов.
Электроны в атоме азота распределены в следующем порядке:1s2 2s2 2p3.
По три электрона от атомов N и H участвуют в формировании связи азот-водород. После этого у азота остается еще два электрона s-типа, которые он может предоставить для образования связи по донорно-акцепторному механизму.
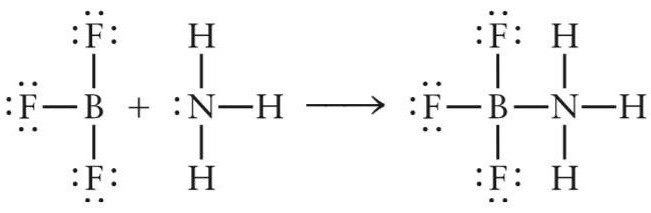
В реакции взаимодействия трифторида бора и аммиака молекула NH3 играет роль донора электронов, а молекула BF3 – акцептора. Пара электронов азота занимает свободную орбиталь фторида бора и образуется химическое соединение NH3BF3.
Другой пример механизма образования донорно-акцепторной связи — получение полимера фторида бериллия.
Схематически реакция выглядит следующим образом:
BeF2+BeF2+…+BeF2->(BeF2)n
Электроны в атоме Be расположены так — 1s2 2s2, а в атоме F — 1s2 2s2 2p5.
Две связи бериллий-фтор в молекуле фторида бериллия ковалентные обменного типа (участвуют два p-электрона от двух атомов фтора и два электрона s-подуровня атома бериллия).
Между парой атомов бериллия (Be) и фтора (F) формируются еще две ковалентные связи по донорно-акцепторному механизму. В полимере фторида бериллия атом фтора — это донор электронов, атом бериллия – их акцептор, имеющий вакантную орбиталь.
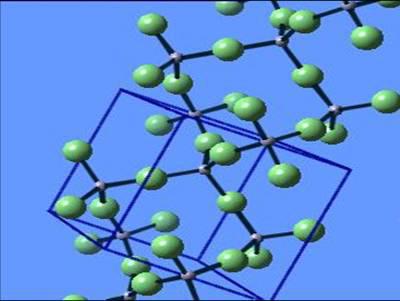
Донорно-акцепторный механизм образования ковалентной связи между органическими молекулами
Когда происходит формирование связи по рассматриваемому механизму между молекулами органической природы, образуются более сложные соединения — комплексы. В любом органическом соединении с ковалентной связью содержатся как занятые (несвязывающие и связывающие), так и пустые орбитали (разрыхляющие и несвязывающие). Возможность донорно-акцепторного образования комплексов определяется степенью устойчивости комплекса, которая зависит от прочности связи.
Рассмотрим пример — реакция взаимодействия молекулы метиламина с соляной кислотой с образованием хлорида метиламмония. В молекуле метиламина все связи ковалентные, образованные по обменному механизму – две связи H-N и одна связь N-CH3. После соединения с водородом и метильной группой у атома азота есть еще пара электронов s-типа. Являясь донором, он предоставляет эту электронную пару для атома водорода (акцептор), у которого есть свободная орбиталь.
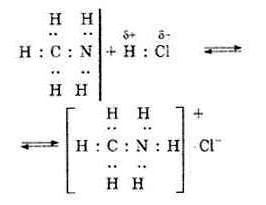
Донорно-акцепторный механизм без формирования химической связи
Не во всех случаях донорно-акцепторного взаимодействия происходит обобществление электронной пары и образование связи. Некоторые органические соединения могут объединяться между собой за счет перекрывания заполненной орбитали донора с пустой орбиталью акцептора. Происходит перенос заряда – электроны делокализуются между акцептором и донором, расположенными очень близко друг к другу. Образуются комплексные соединения с переносом заряда (КПЗ).
Такое взаимодействие характерно для пи-систем, орбитали которых легко перекрываются, а электроны легко поляризуются. В роли доноров могут выступать металлоцены, ненасыщенные аминосоединения, ТДАЭ (тетракис(диметиламино)этилен). Акцепторами зачастую являются фуллерены, хинодиметаны, имеющие акцепторные заместители.
Перенос заряда может быть как частичным, так и полным. Полный перенос заряда происходит при фотовозбуждении молекулы. При этом образуется комплекс, который можно наблюдать спектрально.
Независимо от полноты переноса заряда, такие комплексы неустойчивы. Для повышения прочности и времени жизни такого состояния дополнительно внедряют мостиковую группу. В результате этого донорно-акцепторные системы успешно используются в устройствах преобразования солнечной энергии.
В некоторых органических молекулах связь по донорно-акцепторному механизму формируется внутри молекулы между донорной и акцепторной группой. Такой тип взаимодействия носит название трансаннулярного эффекта, характерного, к примеру, для атранов (элементоорганические соединения со связями N->B, N->Si).
Семиполярная связь, или Дативный механизм образования связи
Кроме обменного и донорно-акцепторного существует третий механизм – дативный (другие названия – семиполярная, полуполярная или координационная связь). Атом-донор отдает пару электронов на свободную орбиталь нейтрального атома, которому необходимы два электрона, чтобы завершить внешний уровень. Происходит своеобразный переход электронной плотности от акцептора к донору. При этом донор становится положительно заряженным (катион), а акцептор – отрицательно заряженным (анион).
Собственно химическая связь формируется за счет связывающей оболочки (перекрывания двух спаренных электронов одного из атомов внешней свободной орбиталью другого) и электростатической притяжения, возникающего между катионом и анионом. Таким образом, в семиполярной связи сочетаются ковалентный и ионный типы. Полуполярная связь характерна для d-элементов, которые в разных соединениях могут играть роли и акцептора, и донора. В большинстве случаев она встречается в комплексных и органических веществах.
Примеры дативной связи
Самый простой пример – молекула хлора. Один атом Cl отдает пару электронов другому атому хлора, у которого есть свободная d-орбиталь. При этом один атом Cl заряжается положительно, другой – отрицательно, и между ними возникает электростатическое притяжение. Из-за большой длины дативная связь имеет меньшую прочность в сравнении с ковалентной обменного и донорно-акцепторного типа, но ее наличие повышает прочность молекулы хлора. Именно поэтому молекула Cl2 более прочна, чем F2 (у атома фтора нет d-орбиталей, связь фтор-фтор только ковалентная обменная).
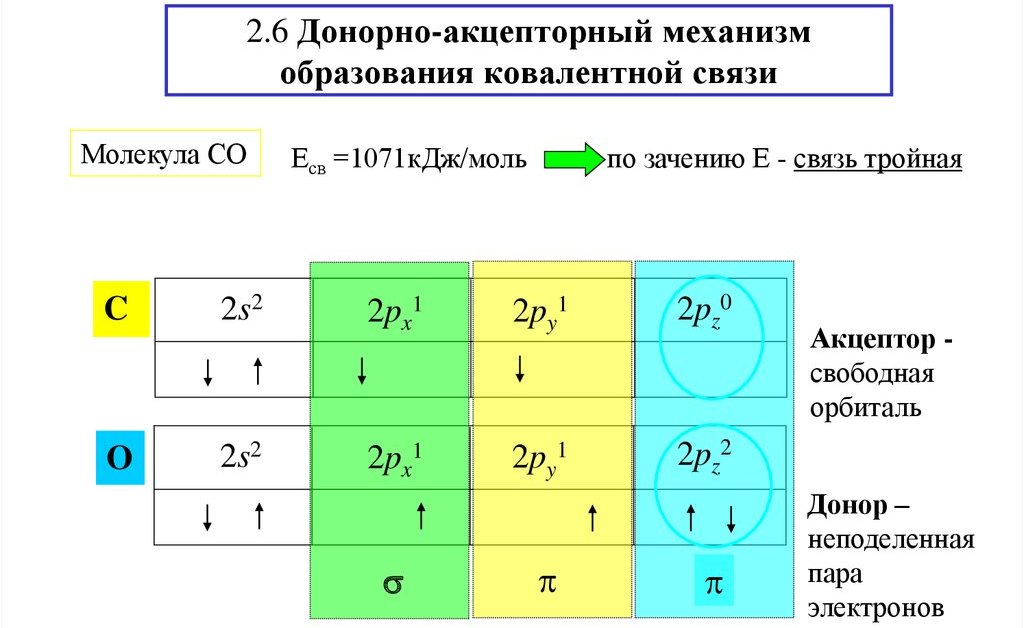
Молекула монооксида углерода CO (угарный газ) образована за счет трех связей C-O. Поскольку у атомов кислорода и углерода на внешнем уровне имеется по два одиночных электрона, между ними формируется две ковалентные обменные связи. После этого у атома углерода остается вакантная орбиталь, у атома O — две пары электронов на внешнем уровне. Поэтому в молекуле монооксида углерода (II) есть третья связь – семиполярная, формирующаяся за счет двух валентных спаренных электронов кислорода и свободной орбитали углерода.
Рассмотрим более сложный пример — образование данного вида связи на примере взаимодействия диметилового эфира (Н3С-О-СН3) с хлоридом алюминия AlCl3. Атом кислорода в диметиловом эфире связан двумя ковалентными связями с метильными группами. После этого у него остается еще два электрона на p-подуровне, которые он отдает атому-акцептору (алюминий) и становится положительным катионом. При этом атом-акцептор приобретает отрицательный заряд (превращается в анион). Катион и анион электростатически взаимодействуют друг с другом.
Значение донорно-акцепторной связи
Механизм образования донорно-акцепторной связи имеет важное значение в жизни человека и широко распространен в химических соединениях как органической, так и неорганической природы, что подтверждают рассмотренные выше примеры. Нашатырный спирт, в составе которого есть катион аммония, успешно применяется в быту, медицине и промышленном производстве удобрений. Ион гидроксония играет главную роль в растворении кислот в воде. Угарный газ применяется в промышленности (например, при производстве удобрений, лазерных систем) и имеет огромное значение в физиологических системах организма человека.
Донорно-акцепторная связь — это… Что такое Донорно-акцепторная связь?
Донорно-акцепторный механизм (иначе координационный механизм) — способ образования ковалентной химической связи между двумя атомами или группой атомов, осуществляемый за счет неподеленной пары электронов атома-донора и свободной орбитали атома-акцептора.
Донорами обычно выступают атомы азота, кислорода, фосфора, серы и др., имеющие неподелённые электронные пары на валентных орбиталях малого размера. Роль акцептора могут выполнять ионизированный атом водорода H+, некоторые p-металлы (напр., алюминий при образовании иона AlH4—) и, в особенности, d-элементы, имеющие незаполненные энергетические ячейки в валентном электронном слое.
Именно с позиций донорно-акцепторного механизма описывается образование локализованных ковалентных связей в молекулах и молекулярных ионах комплексных (координационных) соединений: связь формируется за счёт неподелённой пары электронов лиганда и свободной орбитали атома-комплексообразователя. Донорно-акцепторный механизм также описывает образование промежуточных продуктов (интермедиатов) реакции, например, комплексов с переносом заряда.
Модель донорно-акцепторного механизма существует только в рамках представлений о валентности как о локализации электронной плотности при образовании ковалентных связей (метод валентных схем). В рамках метода молекулярных орбиталей необходимости в подобных представлениях нет.
См. также
6. Донорно-акцепторное взаимодействие
Если одна из двух молекул имеет атом со свободными орбиталями, а другая — атом с парой неподелённых электронов, то между ними происходит донорно-акцепторное взаимодействие, которое приводит к образованию ковалентной связи, например:
NH3 + BF3 = NH3BF3
У атома азота в молекуле аммиака имеется неподеленная пара электронов, а у атома бора в молекуле трифторида бора — вакантная орбиталь.
При взаимодействии по донорно — акцепторному механизму атом азота отдает на связь пару электронов, а атом бора — вакантную орбиталь, в результате чего возникает ковалентная связь:
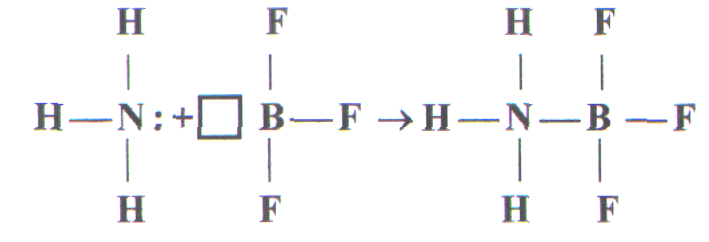
донор акцептор
Аналогичным образом образуется комплексное соединение при взаимодействии сульфата меди и аммиака:
CuSO4 + 4NH3 = [Cu (NH3)4] SO4
7. Водородная связь.
Водородная связь осуществляется между поляризованным водородом одной молекулы и каким-то электроотрицательным атомом или группой атомов другой или одной и той же молекулы (например, кислородом, гидроксогруппой, фтором, азотом, карбоксильной группой, реже хлором, серой и др.):
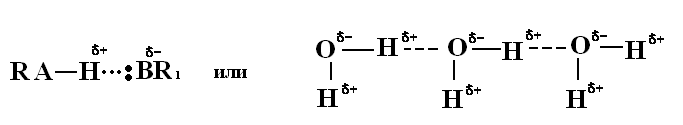
С одним из атомов (А) водород обычно связан значительно сильнее (за счет ковалентной связи), чем с другим (В). Последняя связь получила название водородной. Ее обычно изображают точками или пунктиром.
Водородная связь — это промежуточный случай между ван-дер-ваальсовым взаимодействием и ковалентной связью. Она по прочности превосходит ван-дер-ваальсово взаимодействие, и ее энергия составляет 8 — 40 кДж/моль. Однако она обычно на порядок слабее ковалентной связи.
Например, в твердом, жидком и даже в газовом состоянии молекулы фторида водорода НF ассоциированы в зигзагообразные цепочки вида
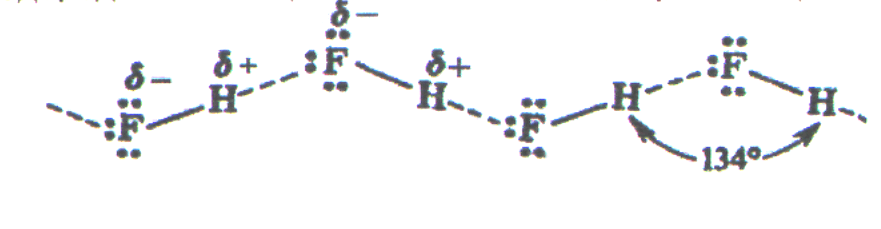
,
что обусловлено водородной связью.
Молекула воды может образовывать четыре водородные связи, так как имеет два атома водорода и две несвязывающие электронные пары:
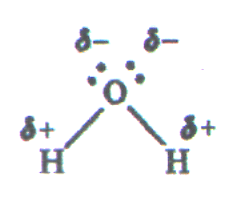
Эта способность молекулы воды обусловливает строение воды и льда.
Раздел 2. Основные закономерности протекания химических процессов.
2.1. Основные понятия химической термодинамики.
Основные понятия термодинамики.
Внутренняя энергия и энтальпия системы. Первый закон термодинамики. Тепловой эффект химической реакции.
Факторы, определяющие глубину и направленность химических реакций. Понятия об энтропии и энергии Гиббса. Второй и третий законы термодинамики.
Термодинамические представления о равновесном состоянии.
1.Основные понятия термодинамики.
Химическая термодинамика изучает энергетические эффекты, сопровождающие химические процессы, зависимость их от условий протекания, вероятность самопроизвольного течения процесса, их направление и пределы.
Термодинамический подход к изучению систем состоит в том, чтобы мысленно изолировать объект исследования от окружающей среды, называемой термодинамической системой.
Система, лишенная возможности обмена веществом или энергией с окружающей средой и имеющая постоянный объём, называется изолированной или замкнутой.
Фаза – это часть системы с одинаковыми физическими и химическими свойствами.
Различают гомогенные и гетерогенные системы.
Гомогенная система – это однородная система, имеющая одну фазу (воздух, любая газовая смесь и т.д.).
Гетерогенная система – это система, имеющая две или более фазы (насыщенный раствор с осадком, уголь в атмосфере воздуха).
Различают фазовые и химические превращения. При химических превращениях изменяется состав и свойства химических соединений. При фазовых превращениях не затрачивается состав и свойства химического вещества (плавление льда, превращение воды в пар и т.д.)
Совокупность термодинамических свойств системы называется её состоянием.
Величины, позволяющие определить состав системы, называются параметрами (состав, концентрация, давление, объём, температура).
Состав системы может быть равновесным и неравновесным.
Равновесное состояние – это такое состояние системы, которое с течением времени самопроизвольно не изменяется (т.е. без каких-либо внешних воздействий на систему её параметры остаются неизменными). Напротив, состав системы будет неравновесным, если параметры её изменяются во времени при отсутствии внешнего воздействия.
Равновесное состояние может быть устойчивым и ограниченным (метостабильное состояние), причём в ограниченном состоянии система стремится занять устойчивое состояние.
Переход термодинамической системы из одного состояния в другое, сопровождающееся изменением параметров системы, называется процессом.
Процесс, при котором термодинамическая система, пройдя через ряд промежуточных состояний, возвращается в исходное состояние, называется круговым процессом или циклом.
В зависимости от того, какие параметры системы при переходе её из одного состояния в другое, остаются постоянными, процессы делятся на:
изотермические (Т = const),
изохорические (V = const),
изобарические (P=const),
адиабатические (отсутствует теплообмен с окружающей средой).
Параметры системы дают возможность ввести переменные, позволяющие характеризовать состояние системы, следовательно, происходящие в ней изменения. Это термодинамические функции:
внутренняя энергия u,
энтальпия H,
энтропия S,
энергия Гиббса G.
Данные функции являются функциями состояния, т.е. их значения определяются только начальными и конечными параметрами системы и не зависят от пути перехода, по которому протекает процесс.

