Акцептор — Словарь — Линкбилдер
Акцептор (от англ. acceptor) – термин в SEO-сфере, обозначающий страницу, веб-сайт или же документ на который ведет проставленная ссылка. В свою очередь уместно сразу же выделить такой термин, как донор – ресурс, размещающий у себя ссылку.

Взаимосвязь между акцептором и донором
Мы не случайно в статье об «акцепторе» упомянули термин «донор». Это объясняется тем, что между ними существует неразрывная связь. В целом ее, взаимосвязь, можно обрисовать довольно просто – пользователь попал на страницу некого портала, назовем его Сайт 1. Просматривая информацию, он обнаружил ссылку, кликнув по которой, перешел уже на другой ресурс, условно обозначим его Сайт 2.
Нами была описана схема связи между «донором» и «акцептором» с точки зрения обычного рядового пользователя сети Интернет. Однако она имеет и внутреннюю сторону, играющую первостепенное значение для поисковых систем (ПС).
Как известно, каждый сайт или страница обладают определенным весом, иначе говоря, авторитетностью в глазах поисковых систем. При размещении ссылки «донор» передает свой вес «акцептору», в результате чего тот поднимает свою авторитетность в глазах ПС.
Одновременно акцептор может быть донором, а донор, в свою очередь, акцептором.
Влияние качества ссылок на акцептор
Как вы уже успели понять из вышенаписанного, акцептор повышает свой вес в «глазах» поисковых систем за счет доноров. Поэтому следует тщательно подходить к выбору площадок-доноров. Не всегда количество означает качество.
В связи с этим перечислим основные критерии, предъявляемые к донору, соответствие которым обеспечит положительное влияние на акцептор:
- две-три ссылки на донорской странице;
- высокая трастовость донора;
- схожая тематичность донора и акцептора;
- естественный, «живой» характер происхождения ссылки.
Соблюдение этих критериев обеспечит увеличение веса акцептора, а вместе с ним и улучшение его позиций в поисковой выдаче.
Заказывая продвижение своих проектов в сервисе «Линкбилдер», вы можете не беспокоиться за качество проставляемых естественных ссылок. Все они отвечают вышеперечисленным требованиям. Поэтому можно смело ожидать положительной реакции поисковых систем на новые бэк-линки, а вместе с ней и рост позиций.
Донорно-акцепторный механизм
Донорно-акцепторный механизм – образование ковалентной связи за счёт двухэлектронного облака одного атома(донор) и свободной орбитали другого(акцептор).
Примерами образования химической связи по донорно-акцепторному механизму являются:
а) реакция аммиака с ионом водорода:
H+ + ׃NH3 = NH4+
Роль
акцептора электронной пары играет
пустая орбиталь иона водорода. В ионе
аммония NH
б) такая связь образуется между атомом азота в молекуле метиламина CH3NH2 и протоном H+ кислоты HCl:
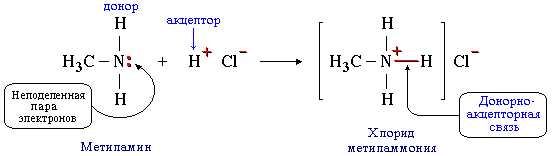
Атом азота отдает свою электронную пару на образование связи и выступает в роли донора, а протон предоставляет вакантную орбиталь, играя роль акцептора. Атом-донор при этом приобретает положительный заряд.
в) реакция валентно насыщенных соединений аммиака и трифторида бора:
F3B + ׃NH3 = F3B׃NH3
акцептор донор1
В молекуле аммиака заселены все четыре орбитали азота, из них три – по обменному механизму электронами азота и водорода, а одна содержит электронную пару, оба электрона которой принадлежат азоту. Такая электронная пара называется неподеленной электронной парой. Образование соединения H 3N · BF3 происходит за счет того, что неподеленная электронная пара аммиака занимает вакантную орбиталь фторида бора. При этом уменьшается потенциальная энергия системы и выделяется эквивалентное количество энергии.
В соединении H3N · BF3 азот и бор – четырехвалентны. Атом азота повышает свою валентность от 3 до 4 в результате использования неподеленной электронной пары для образования дополнительной химической связи. Атом бора повышает валентность за счет наличия у него свободной орбитали на валентном электронном уровне. Таким образом, валентность элементов определяется не только числом неспаренных электронов, но и наличием неподеленных электронных пар и свободных орбиталей на валентном электронном уровне.
Донорно-акцeпторная связь отличается только способом образования; по свойствам она одинакова с остальными ковалентными связями.
Сeмипoлярная связь является разновидностью донорно-акцепторной связи. Образование этой связи происходит при взаимодействии атома-донора пары электронов и атома-акцептора, не имеющих формальных зарядов. При этом на атоме-доноре возникает положительный заряд, а на атоме-акцепторе, предоставившем вакантную орбиталь, – отрицательный.
Например:

Атом кислорода в молекуле диметилового эфира (CH3)2O отдает свою неподеленную пару электронов для образования связи с атомом алюминия, имеющим во внешнем слое только 6 электронов и готовым его дополнить до 8 в соответствии с правилом октета). В результате на атоме кислорода появляется положительный заряд, а на атоме алюминия – отрицательный. Противоположные по знаку заряды на ковалентно-связанных атомах вызывают их дополнительное электростатическое притяжение (ионную связь).
Сочетание ковалентной и ионной связей называют сeмиполярной связью.
К семиполярным связям относится также связь азот-кислород в нитрогруппе NO2, входящей в состав азотной кислоты HO–NO2, ее солей и эфиров, а также нитросоединений R–NO2:
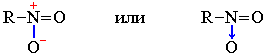
В приведенных формулах нитросоединения связи азота с кислородом неравноценны. Однако, как показывают результаты физических исследований, эти связи энергетически совершенно одинаковы. Следовательно, электронная пара, обусловливающая отрицательный заряд, не сосредоточена целиком на каком-либо одном кислородном атоме, а несколько смещена к азоту при одновременном смещении от азота ко второму кислородному атому подвижной π-электронной пары двойной связи. В результате выравнивания электронной плотности в нитрогруппе формальный отрицательный заряд (-1) распределяется поровну (-1/2) между обоими атоми кислорода:

В плоском треугольном ионе (NO3)— делокализованные π-связи равномерно распределяются между всеми атомами кислорода. Точно также делокализованные π-связи равномерно распределяются между всеми атомами кислорода в соединениях (BO3)3- ,(CO3)2-,SO3 , в BF3 – между всеми атомами фтора,в анионах (PO4)3- и (SO4)2- , имеющих тетраэдрическое строение делокализованные связи равномерно распределяются между всеми атомами кислорода
( рис.2 )
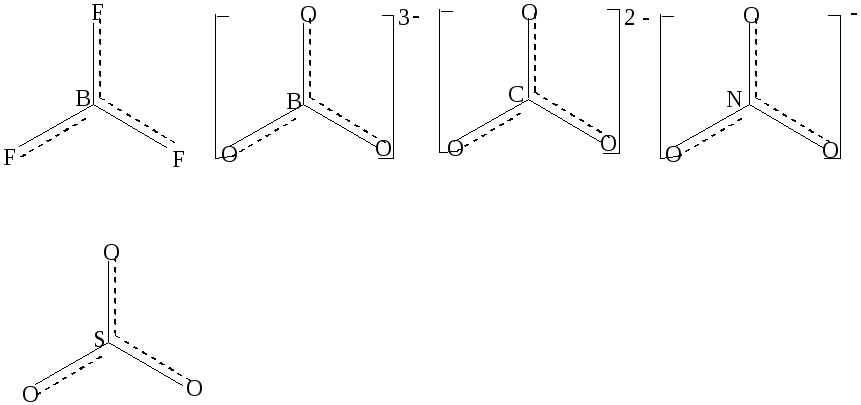
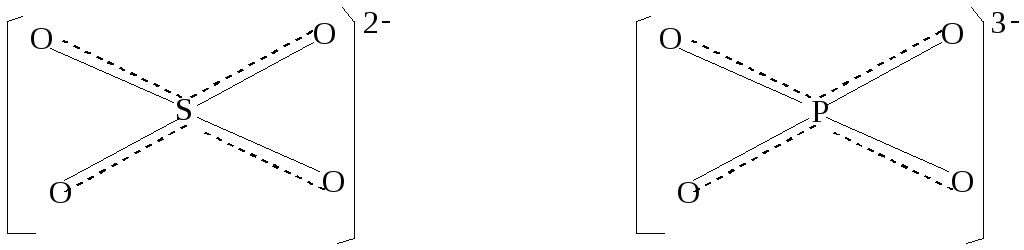
Рис.2 Структурные формулы некоторых с соединений с учётом делокализации π-связи.
взаимодействие, донорно-акцепторное
взаимодействие, донорно-акцепторное иначе донорно-акцепторная связь; координационная связь; пернос заряда (англ. donor-acceptor interaction, coordination bond, charge transfer) — взаимодействие, основанное на переносе заряда или передаче пары электронов от донора к акцептору.Описание
Донорно-акцептороное взаимодействие включает случаи переноса заряда между молекулами донора и акцептора без образования между ними химической связи и передачи неподеленной электронной пары от донора к акцептору, приводящей к образованию связи.
В первом случае речь может идти, например об органических донорах, в частности — -донорах, например, тетракис(диметиламино)этилене (ТДАЭ), других ненасыщенных аминосоединениях, металлоценах и т. п., и органических акцепторах, таких как фуллерены или хинодиметаны с акцепторными заместителями. При взаимодействии таких соединений образуется комплекс с переносом заряда, в котором отрицательно заряженный акцептор и положительно заряженный донор взаимодействуют электростатически. Важную роль играют такие системы, где в основном электронном состоянии перенос заряда только частичный, тогда как состояние с практически полным переносом заряда может быть получено при фотовозбуждении. Подобные системы, донорно-акцепторные диады, а также триады, в которых между донором и акцептором внедрена мостиковая группа, способствующая повышению времени жизни состояния с переносом заряда, могут использоваться для создания устройств для преобразования солнечной энергии (см. например, искусственный фотосинтез). Вообще, перенос заряда в различных его формах и проявлениях играет ключевую роль во многих биологических процессах.
Во втором случае донор и акцептор представляют собой, соответственно, кислоту и основание Льюиса. Если обычная ковалентная связь между двумя атомами обусловлена образованием общей пары электронов — по одному от каждого атома, то донорно-акцепторная связь осуществляется за счет пары электронов донора и свободной (незаполненной) орбитали акцептора. Этот вид донорно-акцепторного взаимодействия — основной способ образования комплексных соединений (рис.). Подобное взаимодействие отвечает за многие кислотно-основные превращения, связанные с переносом иона водорода (акцептора), а также образование супрамолекулярных наноструктур.
Иллюстрации
Схема образования донорно-акцепторных связей в комплексе Co(NH3)63+. При образовании иона Cr3+ возникают 3 дополнительные свободные орбитали (две — 3d, одна — 4s), которые наряду с 4p-орбиталями заполняются 6 парами электронов от молекул NH3, участвующих в образовании данного комплекса. |
Автор
- Еремин Вадим Владимирович
Источник
- Донорно-акцепторная связь // Химическая энциклопедия. Т. 2. — М.: Советская энциклопедия, 1990. С. 463–464.
CO Нужно определить где донор, а где акцептор.
Ответ есть от тут <a rel=»nofollow» href=»https://vk-wiki02.blogspot.com?0=270131″ target=»_blank»>vk.com/wiki-18832533-37270131236</a>
Отвт есть вот тут <a rel=»nofollow» href=»https://vk-wiki02.blogspot.com?0=11519″ target=»_blank»>vk.com/wiki-18832533-3711519236</a>
Ответесть вот тут <a rel=»nofollow» href=»https://vk-wiki02.blogspot.com?0=493861″ target=»_blank»>vk.com/wiki-18832533-37493861236</a>
Акцепторы и доноры бывают только в молекулах с донорно-акцепторной связью. Например, молекула аммиака NH₃ оттягивает к себе протон Н⁺ от молекулы воды Н₂О и образуется ион NH₄⁺. Здесь атом N — акцептор, атом О — донор. В молекуле СО атом О частично притягивает к себе 2 электрона от атома С, но ничего здесь донорами или акцепторами не называют.
Акцепторные заместители
В акцепторных заместителях наблюдается дефицит электронов на π-орбиталях атомов, связанных с бензольным кольцом ($-NO_2$, -$COR$, $-SO_3H$ и др.). Эти заместители можно представить в виде условной группы или индивидуального атома $X$, имеющего пустую $p$-орбиталь.
Заместители II рода
Заместители II рода (метаориентанты в реакции $Se$) — это группы атомов, которые являются акцепторами электронов. Они имеют целый или частично позитивных заряд на атоме, который непосредственно соединен с ароматическим ядром:

Заместители II рода уменьшают электронную плотность в бензольном ядре и снижают скорость реакции $Sе$ по сравнению с незамещенным бензолом.
Так наличие нитрогруппы $(-NO_2$) требует более «жестких» условий нитрования нитробензола, и скорость реакции уменьшается по сравнению с нитрованием незамещенного бензола.
Механизм ориентирующего действия заместителей II рода
Механизм ориентирующего действия заместителей II рода (реакция $Sе$) заключается в том, что они уменьшают степень делокализации положительного заряда $\sigma$-комплекса по сравнению с незамещенным $\sigma$-комплексом бензола. При этом стабильность такого $\sigma$-комплекса уменьшается, а энергия активации увеличивается, что приводит к уменьшению скорости реакции. Сравнение относительной стабильности орто-, мета- и пара- $\sigma$-комплексов рассмотрим на примере реакции нитрования нитробензола:

Приведенная схема показывает, что в случае мета- $\sigma$-комплекса делокализация заряда происходит согласно трем пограничными структурам (I-III), тогда как в случае орто- и пара- $\sigma$-комилексов структуры (III) крайне невыгодны, поскольку положительные заряды находятся на двух смежных атомах и вероятность их существования очень мала. Поэтому делокализация положительного заряда в случае орто- и пара- $\sigma$-комилексов фактически сводится к двум пограничным структурам І и II, поэтому реакция идет преимущественно в мета- положение.
Заместители, которые проявляют -І-эффект
Индукционный эффект — передача электронного влияния при поляризации σ-связей в результате различной электроотрицательности атомов — участников связи.
К заместителям, которые проявляют -$І$-эффект, относятся элементы, более электроотрицательные, чем углерод $(Hal, В, N, S)$, и группы атомов, которые содержат фрагменты с ненасыщенными связями, а также группы атомов с полным положительным зарядом на атоме, который напрямую соединен с углеродом. Исходя из того что электроотрицательность растет в таблице элементов слева направо и снизу вверх, заместители по силе проявления -$І$-эффекта располагают в соответствующие ряды (по К. Ингольду):

Для одного и того же элемента -$І$-эффект увеличивается с ростом его электроотрицательности:

Заместители, которые проявляют +М-эффект
К заместителям акцепторам с -М-эффектом относятся заместители, атомы которых имеют свободную орбиталь или орбиталь с низкой энергией (карбокатион углерода, атом бора), а также ненасыщенные двойные и тройные связи.

Карбонильная группа $C = O$ во многих случаях входит в состав производных групп, которые при уменьшении действия -М-эффекта располагаются в ряд:

-M-Эффект увеличивается с ростом разницы между значениями электроотрицательности атомов, которые образуют группировки $C = Y$. Кроме того, -М-эффект проявляется для соединений строения $C=C-Y$, где $Y$ — не только катионы, но и такие акцепторные группы, как $-CF_3$ -$CCl_3$ и т.д.
Проявление мезомерного эффекта в основном сильнее, чем индукционного. По цепи соединений с сопряженной системой связей мезомерннй эфект передается на значительное расстояние. Это вызвано тем, что способность к поляризации $\pi$-электронов выше, чем σ-электронов, вследствии их большего удаления от ядра и меньшего ядерно-электронного взаимодействия с ним.
В отличие от $I$-эффекта, когда электронная плотность от связи смещается к более электроотрицательному атому вдоль связи, для M-эффекта электронная плотность π-связи частично или полностью смещается к смежным связям.

