Диоксид углерода — Википедия
| Диоксид углерода | |||
|---|---|---|---|
| |||
({{{изображение}}}) | |||
| Систематическое наименование | Диоксид углерода | ||
| Традиционные названия | углекислый газ, углекислота, двуокись углерода, сухой лёд (в твёрдом состоянии) | ||
| Хим. формула | CO2 | ||
| Рац. формула | CO | ||
| Состояние | бесцветный газ | ||
| Молярная масса | 44,01 г/моль | ||
| Плотность | газ (0 °C): 1,9768 кг/м³ жидкость (0 °С, 35,5 ат): 925 кг/м³ тв. (−78,5 °C): 1560 кг/м³ | ||
| Динамическая вязкость | 8,5⋅10−5 Па·с (10°C, 5,7 МПа) | ||
| Энергия ионизации | 13,77 ± 0,01 эВ[2] | ||
| Скорость звука в веществе | 269 м/с | ||
| Температура | |||
| • сублимации | −78,5 °C | ||
| Тройная точка | −56,6 °C, 0,52 МПа [1] | ||
| Критическая точка | 31 °C, 7,38 МПа | ||
| Критическая плотность | 467 кг/м³ см³/моль | ||
| Уд. теплоёмк. | 849 Дж/(кг·К) | ||
| Теплопроводность | 0,0166 Вт/(м·K) | ||
| Энтальпия | |||
| • образования | 394 кДж/моль | ||
| • плавления | 9,02 кДж/моль | ||
| • кипения | 16,7 кДж/моль | ||
| • сублимации | 26 кДж/моль | ||
| Удельная теплота испарения | 379,5 кДж/кг | ||
| Удельная теплота плавления | 205 кДж/кг | ||
| Давление пара | 56,5 ± 0,1 атм[2] | ||
| Растворимость | |||
| • в воде | 1,48 кг/м³ | ||
| Рег. номер CAS | 124-38-9 | ||
| PubChem | 280 | ||
| Рег. номер EINECS | 204-696-9 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E290 | ||
| RTECS | FF6400000 | ||
| ChEBI | 16526 | ||
| Номер ООН | 1013 | ||
| ChemSpider | 274 | ||
| Предельная концентрация | 9 000 мг/м3 | ||
| ЛД50 | LC50: 90 000 мг/м3*5 мин (человек, ингаляция) | ||
| Токсичность | Нетоксичен. Опасен лишь в очень больших количествах (обладает удушающим действием). Негорюч. | ||
| Фразы безопасности (S) | S9, S23, S36 | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
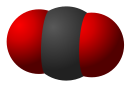
Диокси́д углеро́да или двуо́кись углеро́да (также углеки́слый газ, углекислотá, окси́д углеро́да(IV), у́гольный ангидри́д) — бесцветный газ (в нормальных условиях), почти без запаха (в больших концентрациях с кисловатым «содовым» запахом), с химической формулой CO2.
Плотность при нормальных условиях 1,98 кг/м³ (в 1,5 раза тяжелее воздуха). При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное (возгонка). Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,04 %
Физические[править | править код]

Оксид углерода (IV) (углекислый газ) — бесцветный газ, при малых концентрациях в воздухе не имеет запаха, при больших концентрациях имеет характерный кисловатый запах газированной воды. Тяжелее воздуха приблизительно в 1,5 раза.
Молекула углекислого газа линейна, расстояние от центра центрального атома углерода до центров двух атомов кислорода 116,3 пм.
При температуре −78,3 °С кристаллизуется в виде белой снегообразной массы — «сухого льда». Сухой лёд при атмосферном давлении не плавится, а испаряется, не переходя в жидкое состояние, температура сублимации −78 °С. Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм) газ сгущается в бесцветную жидкость. В спокойном электрическом разряде светится характерным бело-зелёным светом.
Негорюч, но в его атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щелочноземельных — магния, кальция, бария.
Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Растворим в воде (0,738 объёмов углекислого газа в одном объёме воды при 15 °С).
Химические[править | править код]
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует нестойкую угольную кислоту. Реагирует со щёлочами с образованием её солей — карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Оксид углерода(IV) останавливает горение, вытесняя кислород из зоны реакции. В нём горят только некоторые активные металлы[5]:
- 2Mg+CO2⟶2MgO+C{\displaystyle {\ce {2Mg + CO2 -> 2MgO + C}}}.
Взаимодействие с оксидом активного металла:
- CaO+CO2⟶CaCO3{\displaystyle {\ce {CaO + CO2 -> CaCO3}}}.
При растворении в воде образует равновесную смесь раствора диоксида углерода и угольной кислоты, причём равновесие сильно сдвинуто в сторону разложения кислоты:
- CO2+h3O⇄h3CO3{\displaystyle {\ce {CO2^{+}h3O\rightleftarrows h3CO3}}}.
Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов:
- Ca(OH)2+CO2⟶CaCO3↓+h3O{\displaystyle {\ce {Ca(OH)2 + CO2 -> CaCO3 v + h3O}}} (качественная реакция на углекислый газ),
- KOH+CO2⟶KHCO3{\displaystyle {\ce {KOH + CO2 -> KHCO3}}}.
Биологические[править | править код]
Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.[6]
Этот углекислый газ переносится от тканей, где он образуется в качестве одного из конечных продуктов метаболизма, по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и мало в артериальной крови. Содержание углекислого газа в пробе крови часто выражают в терминах парциального давления, то есть давления, которое бы имел содержащийся в пробе крови в данном количестве углекислый газ, если бы весь объём пробы крови занимал только он[7].
Содержание углекислого газа в крови человека приблизительно таково:
Референтные значения или средние значения парциального давления углекислого газа в крови (pCO2) Единицы измерения Газ венозной крови Альвеолярный лёгочный газ Газ артериальной крови кПа 5,5[8]—6,8[8] 4,8 4,7[8]—6,0[8] мм рт. ст. 41—51 36 35[9]—45[9]
Углекислый газ транспортируется в крови тремя различными способами (точное соотношение каждого из этих трёх способов транспортировки зависит от того, является ли кровь артериальной или венозной).
- Бо́льшая часть углекислого газа (от 70 % до 80 %) преобразуется ферментом карбоангидразой эритроцитов в ионы гидрокарбоната[10] при помощи реакции CO2+h3O⟶h3CO3⟶H++HCO3−{\displaystyle {\ce {CO2 + h3O -> h3CO3 -> H^+ + HCO3^-}}}.
- Около 5—10 % углекислого газа растворено в плазме крови[10].
- Около 5—10 % углекислого газа связано с гемоглобином в виде карбаминосоединений (карбогемоглобин)[10].
Гемоглобин, основной кислород-транспортирующий белок эритроцитов крови, способен транспортировать как кислород, так и углекислый газ. Однако углекислый газ связывается с гемоглобином в ином месте, чем кислород. Он связывается с N-терминальными концами цепей глобина, а не с гемом. Однако благодаря аллостерическим эффектам, которые приводят к изменению конфигурации молекулы гемоглобина при связывании, связывание углекислого газа понижает способность кислорода к связыванию с ним же, при данном парциальном давлении кислорода, и наоборот — связывание кислорода с гемоглобином понижает способность углекислого газа к связыванию с ним же, при данном парциальном давлении углекислого газа. Помимо этого, способность гемоглобина к преимущественному связыванию с кислородом или с углекислым газом зависит также и от pH среды. Эти особенности очень важны для успешного захвата и транспорта кислорода из лёгких в ткани и его успешного высвобождения в тканях, а также для успешного захвата и транспорта углекислого газа из тканей в лёгкие и его высвобождения там.
Углекислый газ является одним из важнейших медиаторов ауторегуляции кровотока. Он является мощным вазодилататором. Соответственно, если уровень углекислого газа в ткани или в крови повышается (например, вследствие интенсивного метаболизма — вызванного, скажем, физической нагрузкой, воспалением, повреждением тканей, или вследствие затруднения кровотока, ишемии ткани), то капилляры расширяются, что приводит к увеличению кровотока и соответственно к увеличению доставки к тканям кислорода и транспорта из тканей накопившейся углекислоты. Кроме того, углекислый газ в определённых концентрациях (повышенных, но ещё не достигающих токсических значений) оказывает положительное инотропное и хронотропное действие на миокард и повышает его чувствительность к адреналину, что приводит к увеличению силы и частоты сердечных сокращений, величины сердечного выброса и, как следствие, ударного и минутного объёма крови. Это также способствует коррекции тканевой гипоксии и гиперкапнии (повышенного уровня углекислоты).
Ионы гидрокарбоната очень важны для регуляции pH крови и поддержания нормального кислотно-щелочного равновесия. Частота дыхания влияет на содержание углекислого газа в крови. Слабое или замедленное дыхание вызывает респираторный ацидоз, в то время как учащённое и чрезмерно глубокое дыхание приводит к гипервентиляции и развитию респираторного алкалоза.
Кроме того, углекислый газ также важен в регуляции дыхания. Хотя наш организм требует кислорода для обеспечения метаболизма, низкое содержание кислорода в крови или в тканях обычно не стимулирует дыхание (вернее, стимулирующее влияние нехватки кислорода на дыхание слишком слабо и «включается» поздно, при очень низких уровнях кислорода в крови, при которых человек нередко уже теряет сознание). В норме дыхание стимулируется повышением уровня углекислого газа в крови. Дыхательный центр гораздо более чувствителен к повышению уровня углекислого газа, чем к нехватке кислорода. Как следствие этого, дыхание сильно разрежённым воздухом (с низким парциальным давлением кислорода) или газовой смесью, вообще не содержащей кислорода (например, 100 % азотом или 100 % закисью азота) может быстро привести к потере сознания без возникновения ощущения нехватки воздуха (поскольку уровень углекислоты в крови не повышается, ибо ничто не препятствует её выдыханию). Это особенно опасно для пилотов военных самолётов, летающих на больших высотах (в случае аварийной разгерметизации кабины пилоты могут быстро потерять сознание). Эта особенность системы регуляции дыхания также является причиной того, почему в самолётах стюардессы инструктируют пассажиров в случае разгерметизации салона самолёта в первую очередь надевать кислородную маску самим, прежде чем пытаться помочь кому-либо ещё — делая это, помогающий рискует быстро потерять сознание сам, причём даже не ощущая до последнего момента какого-либо дискомфорта и потребности в кислороде[10].
Дыхательный центр человека пытается поддерживать парциальное давление углекислого газа в артериальной крови не выше 50 мм ртутного столба. При сознательной гипервентиляции содержание углекислого газа в артериальной крови может снизиться до 10—20 мм ртутного столба, при этом содержание кислорода в крови практически не изменится или увеличится незначительно, а потребность сделать очередной вдох уменьшится как следствие уменьшения стимулирующего влияния углекислого газа на активность дыхательного центра. Это является причиной того, почему после некоторого периода сознательной гипервентиляции легче задержать дыхание надолго, чем без предшествующей гипервентиляции. Такая сознательная гипервентиляция с последующей задержкой дыхания может привести к потере сознания до того, как человек ощутит потребность сделать вдох. В безопасной обстановке такая потеря сознания ничем особенным не грозит (потеряв сознание, человек потеряет и контроль над собой, перестанет задерживать дыхание и сделает вдох, дыхание, а вместе с ним и снабжение мозга кислородом восстановятся, а затем восстановится и сознание). Однако в других ситуациях, например, перед нырянием, это может быть опасным (потеря сознания и потребность сделать вдох наступят на глубине, и в отсутствие сознательного контроля в дыхательные пути попадёт вода, что может привести к утоплению)[источник не указан 841 день]. Именно поэтому гипервентиляция перед нырянием опасна и не рекомендуется.
- В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов[11] (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать CO2{\displaystyle {\ce {CO2}}}, содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ.
- Также углекислый газ получают на установках разделения воздуха как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой, используя, например, аппарат Киппа[11].
- CaCO3+2HCl⟶CaCl2+h3O+CO2↑{\displaystyle {\ce {CaCO3 + 2HCl -> CaCl2 + h3O + CO2 ^}}}.
Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который замедляет реакцию, и который удаляется значительным избытком кислоты с образованием кислого сульфата кальция.
Для приготовления сухих напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Также для получения углекислого газа применяется зкзотермическая реакция горения углерода в кислороде[11]:
- C+O2⟶CO2↑+394kJ{\displaystyle {\ce {C + O2 -> CO2 ^ + 394 kJ}}}.
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
В криохирургии используется как одно из основных веществ для криоабляции новообразований.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими.
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространённый метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений[12].
Углекислый газ используется для газирования лимонада, газированной воды и других напитков. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31 °С. В стандартный 40-литровый баллон заливают около 20 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см²). Если температура будет выше +31 °С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см²), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа, — таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при их посадке внатяжку) и так далее. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO₂ в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта. Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф. Для измерения низких концентраций CO₂ (а также CO) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе[13].

Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) даёт малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).
Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемого топлива (угля, нефти, газа), заметно увеличивающееся в зимний сезон[14].
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Углекислый газ нетоксичен, но при вдыхании его повышенных концентраций в воздухе по воздействию на воздуходышащие живые организмы его относят к удушающим газам (англ.)русск.. По ГОСТу (ГОСТ 8050-85) углекислота относится к IV классу опасности.
Незначительные повышения концентрации, вплоть до 0,2−0,4 % (2000−4000 ppm), в помещениях приводят к развитию у людей сонливости и слабости. Опасными для здоровья концентрациями считаются концентрации около 7−10 %, при которых развиваются симптомы удушья, проявляющиеся в виде головной боли, головокружения, расстройстве слуха и в потере сознания (симптомы, сходные с симптомами высотной болезни), эти симптомы развиваются, в зависимости от концентрации, в течение времени от нескольких минут до одного часа.
Для помещений нормальным является уровень CO₂ около 600 ppm (частей на миллион). Повышенные концентрации углекислого газа снижают когнитивные способности людей. Уже при 1200 ppm расширяются кровеносные сосуды в мозге, снижается активность нейронов и уменьшается объём коммуникации между регионами мозга. [15]. В школьных классах типичной является концентрация 2000−2500, а общий разброс значений — от 1000 до 6000, это вызывает обеспокоенность у исследователей[16], поскольку выявлено снижение результатов учеников, выполняющих тестовые задания в душных помещениях[17].
| Влияние на взрослых здоровых людей | Концентрация углекислого газа, ppm |
|---|---|
| Нормальный уровень на открытом воздухе | 350—450 |
| Приемлемые уровни | <600 |
| Жалобы на несвежий воздух | 600—1000 |
| Максимальный уровень стандартов ASHRAE и OSHA[18] | 1000 |
| Общая вялость | 1000—2500 |
| Возможны нежелательные эффекты на здоровье | 1000—2500 |
| Максимально допустимая концентрация в течение 8 часового рабочего дня | 5000 |
При вдыхании воздуха с очень высокими концентрациями газа смерть наступает очень быстро от удушья, вызванного гипоксией[19].
Несмотря на то, что даже концентрация 5—7 % CO₂ в воздухе несмертельна, но при концентрации 0,1 % (такое содержание углекислого газа иногда наблюдается в воздухе мегаполисов), люди начинают чувствовать слабость, сонливость. Это показывает, что даже при высоком уровне кислорода, большая концентрация CO₂ существенно влияет на самочувствие человека.
| Симптомы у взрослых здоровых людей[20] | Концентрация углекислого газа, ppm |
|---|---|
| Легкое отравление, учащается пульс и частота дыхания, тошнота и рвота | 30 000 |
| Добавляется головная боль и легкое нарушение сознания | 50 000 |
| Потеря сознания, в дальнейшем — смерть | 100 000 |
Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья. После удаления пострадавшего из атмосферы с высокой концентрацией углекислого газа быстро наступает полное восстановление здоровья и самочувствия[21].
- ↑ Carbon Dioxide — Thermophysical Properties
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0103.html
- ↑ Trends in Atmospheric Carbon Dioxide (англ.). National Oceanic and Atmospheric Administration. Дата обращения 24 сентября 2013.
- ↑ Chen Zhou, Mark D. Zelinka & Stephen A. Klein. Impact of decadal cloud variations on the Earth’s energy budget (англ.). Nature Geoscience. Дата обращения 4 декабря 2019.
- ↑ А. С. Егоров. Репетитор по химии — Ростов-на-Дону: «Феникс», 2009.
- ↑ 7. How much carbon dioxide do humans contribute through breathing?. Frequent Questions — Emissions (англ.). US EPA. Дата обращения 4 декабря 2019. Архивировано 2 февраля 2011 года.
- ↑ Charles Henrickson. Chemistry (неопр.). — Cliffs Notes, 2005. — ISBN 0-7645-7419-1.
- ↑ 1 2 3 4 Пересчитано из значений в мм. рт. ст. с использованием коэффициента пересчёта 0,133322 кПа/мм. рт. ст.
- ↑ 1 2 Таблица референсных значений. Юго-Западный медицинский центр при Университете Далласа.
- ↑ 1 2 3 4 Carbon dioxide (неопр.). solarnavigator.net. Дата обращения 12 октября 2007.
- ↑ 1 2 3 Glinka, Nikolaj Leonidovič (1882-1965). Obŝaâ himiâ. — Izd. 27-e ster. — Leningrad: «Himiâ», 1988. — 702, [2] s. с. — ISBN 5724500035, 9785724500036.
- ↑ Большая Энциклопедия Нефти и Газа.
- ↑ ГОСТ 31371.6-2008 (ИСО 6974-6:2002). Газ природный. Определение состава методом газовой хроматографии с оценкой неопределённости. Часть 6. Определение водорода, гелия, кислорода, азота, диоксида углерода и углеводородов C1 — C8 с использованием трёх капиллярных колонок (рус.). Docs.cntd.ru. — М.: Стандартинформ, 2009.. Дата обращения 4 декабря 2019.
- ↑ Бялко А. В. Растения убыстряют рост // Природа. — 1996. — № 10. (по Keeling C.D., Whorf Т.P., Wahlen M., van der Plicht J. // Nature. 1995. V. 375, № 6533. P.666-670)
- ↑ Greenwood, Veronique. Is Conference Room Air Making You Dumber? : [англ.] // The New York Times : газ. — 2019. — 6 May.
- ↑ Ventilation rates and carbon dioxide concentrations in schools. — In: Ventilation with Outdoor Air : [англ.] // Berkeley Lab : [сайт]. — 2019.
- ↑ Сорокин, Андрей. «Глобальное потепление отупляет. От этого уже страдают школьники и офисные работники» // Republic : [сайт]. — 2020. — 7 января.
- ↑ Indoor Air Quality in Commercial and Institutional Buildings
- ↑ (англ.) Carbon Dioxide as a Fire Suppressant: Examining the Risks, U.S. Environmental Protection Agency:.
- ↑ Приемлемые и опасные уровни концентрации углекислого газа (CO2) согласно ASHRAE и OSHA — США. Рекомендованные уровни вентиляции помещений.
- ↑ (англ.) Glatte Jr H. A., Motsay G. J., Welch B. E. Carbon Dioxide Tolerance Studies (неопр.) // Brooks AFB, TX School of Aerospace Medicine Technical Report. — 1967. — Т. SAM—TR—67—77.
Список физических величин — Википедия
| Производные величины | Символ | Описание | Единица СИ | Примечания |
|---|---|---|---|---|
| Площадь | S | Размер пространства ограниченного замкнутой линией и опирающейся на эту линию поверхностью | м2 | |
| Объём | V | Размер пространства заключённого в трёхмерном объекте | м3 | экстенсивная величина |
| Скорость | v | Изменение положения тела в единицу времени | м/с | вектор |
| Ускорение | a | Изменение скорости в единицу времени | м/с² | вектор |
| Импульс | p | Количество движения тела | кг·м/с | экстенсивная, сохраняющаяся величина |
| Сила | F | Мера взаимодействия материи | кг·м/с2 (ньютон, Н) | вектор |
| Механическая работа | A | Скалярное произведение силы и перемещения. | кг·м2/с2 (джоуль, Дж) | скаляр |
| Энергия | E | Способность тела или системы совершать работу. | кг·м2/с2 (джоуль, Дж) | экстенсивная, сохраняющаяся величина, скаляр |
| Мощность | P | Быстрота совершения работы. | кг·м2/с3 (ватт, Вт) | |
| Давление | p | Сила, действующая на единицу площади поверхности перпендикулярно этой поверхности | кг/(м·с2) (паскаль, Па) | интенсивная величина |
| Плотность | ρ | Масса на единицу объёма. | кг/м3 | интенсивная величина |
| Поверхностная плотность | ρA | Масса на единицу площади. | кг/м2 | |
| Линейная плотность | ρl | Масса на единицу длины. | кг/м | |
| Количество теплоты | Q | Энергия, передаваемая от одного тела к другому немеханическим путём | кг·м2/с2 (джоуль, Дж) | скаляр |
| Электрический заряд | q | Способность тел быть источником электромагнитного поля и принимать участие в электромагнитном взаимодействии | А·с (кулон, Кл) | экстенсивная, сохраняющаяся величина |
| Напряжение | U | Изменение потенциальной энергии, приходящееся на единицу заряда. | м2·кг/(с3·А) (вольт, В) | скаляр |
| Электрическое сопротивление | R | Сопротивление объекта прохождению электрического тока | м2·кг/(с3·А2) (ом, Ом) | скаляр |
| Магнитный поток | Φ | Величина, учитывающая интенсивность магнитного поля и занимаемую им область. | кг·м2/(с2·А) (вебер, Вб) | |
| Частота | ν | Число повторений события за единицу времени. | с−1 (герц, Гц) | |
| Угол | α | Величина изменения направления. | радиан (рад) | |
| Угловая скорость | ω | Скорость изменения угла. | с−1 (радиан в секунду) | |
| Угловое ускорение | ε | Изменение угловой скорости в единицу времени | с−2 (радиан на секунду в квадрате) | |
| Момент инерции | I | Мера инертности объекта при вращении. | кг·м2 | тензорная величина |
| Момент импульса | L | Мера вращения объекта. | кг·м2/c | сохраняющаяся величина |
| Момент силы | M | Произведение силы на длину перпендикуляра, опущенного из точки на линию действия силы. | кг·м2/с2 | вектор |
| Телесный угол | Ω | Часть пространства, которая является объединением всех лучей, выходящих из данной точки и пересекающих некоторую поверхность | стерадиан (ср) |
2 (число) — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 11 октября 2019; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 11 октября 2019; проверки требует 1 правка. Символы со сходным начертанием: Ձ · Զ2 (два, иногда «двойка») — число, цифра и глиф. Натуральное число между 1 и 3.
- Целое число называется чётным, если оно делится на 2.
- Для целых чисел, записанных в системе счисления с чётным основанием (например, в десятичной или шестнадцатеричной), справедливо простое правило: число делится на 2, если его младший разряд делится на 2.
- 2 — наименьшее и первое простое число, единственное чётное простое число ↑3
- 2 — третье число Фибоначчи ↓1, ↑3 как сумма первых двух, 1 и 1.
- 2 — факториальное простое число ↑3 , простое число Лукаса[en], простое число Смарандейка — Веллина[en]
- 1-е число Софи Жермен ↑3 (2 * 2 + 1 = 5, которое также число Софи Жермен)[1].
- 2 — простое число Эйзенштейна без мнимой части и с действительной частью вида 3n−1{\displaystyle 3n-1}
- 2 — простое число Штерна, число Пелля ↓1, ↑5 , а также число Маркова ↓1, ↑5
- 2 — второе число Каталана ↓1, ↑5
- 2 — второе число Белла ↓1, ↑5
- 2 — второе число Моцкина ↓1, ↑4 , первое простое Моцкина ↑127 .
- 2 — одиозное число
- 2 — второе меандровое число ↓1, ↑8 и третье открытое меандровое число ↓1, ↑3 [2][3]
- 2 — делитель числа 10, так что обыкновенные дроби с числом 2 в знаменателе являются конечными.
- 2 — факториал числа 2: 2! = 2.
- 2 — основание простейшей — двоичной — системы счисления, широко используемой в вычислительной технике.
- 2 — тессерактный суперкорень из числа 65 536.
- 2 — второй по счёту факторион ↓1, ↑145 (число, равное сумме факториалов своих цифр в десятичной записи).
- 210 = 102 = 23(и более).
- 2 является суперсовершенным числом — числом n, таким, что σ(σ(n))=2n[4].
- Существует ровно 2 тримино ↓1, ↑5 .
Свойства[править | править код]
Для любого числа x{\displaystyle x}:
- x + x = 2 · x — от сложения к умножению
- x · x = x² — от умножения к возведению в степень
- x x = x↑↑2 — от возведения в степень к hyper4 (↑↑ — нотация Дональда Э. Кнута)
Число 2 обладает также следующим уникальным свойством: 2 + 2 = 2 · 2 = 2² = 2 ↑↑ 2 = 2 ↑↑↑ 2
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 | 22 | 24 | 26 | 28 | 30 | 32 | 34 | 36 | 38 | 40 | 42 | 44 | 46 | 48 | 50 | 52 | 54 | 56 | 58 | 60 |
- David Wells. 2 // The Penguin Dictionary of Curious and Interesting Numbers. — Penguin Books, 1986. — С. 41—44. — 229 с. — ISBN 0-14-008029-5.
- Ламберто Гарсия дель Сид. Первые натуральные числа и их значение → 2; Числа, любопытные с точки зрения арифметики → 2 // Замечательные числа. Ноль, 666 и другие бестии. — DeAgostini, 2014. — Т. 21. — С. 16—17, 54. — 159 с. — (Мир математики). — ISBN 978-5-9774-0716-8.
| Степени | |
|---|---|
| Традиционные битовые единицы | |
| Традиционные байтовые единицы | |
Двоичные приставки — Википедия
Двоичные (бинарные) приставки — приставки перед наименованиями или обозначениями единиц измерения информации, применяемые для формирования кратных единиц, отличающихся от базовой единицы в определённое целое, являющееся целой положительной степенью числа 210, число раз (210 = 1024, (210)2 = 220 = 10242, (210)3 = 230 = 10243 и т. д.). Двоичные приставки используются для образования единиц измерения информации, кратных битам и байтам.
Благодаря близости чисел 1024 и 1000 двоичные приставки построены по аналогии со стандартными десятичными приставками СИ. Наименование каждой двоичной приставки получается заменой последнего слога наименования соответствующей десятичной приставки на би (от лат. bīnārius — двоичный).
Приставки от 210 до 260 (киби, меби, гиби, теби, пеби, эксби) были предложены шведским учёным Андерсом Тором (англ.)русск. и введены Международной электротехнической комиссией (МЭК) в 1999 году во второй поправке к стандарту IEC 60027-2[1][2]. В третьей редакции стандарта IEC 60027-2, принятой в 2005 году, были добавлены приставки 270 и 280 (зеби и йоби)[1][3].
Приказом Федерального агентства по техническому регулированию и метрологии от 9 октября 2015 года N 1508-ст «О введении в действие межгосударственного стандарта» [4] введён в действие с 1 октября 2016 года в качестве национального стандарта Российской Федерации ГОСТ IEC 60027-2-2015 «Обозначения буквенные, применяемые в электротехнике. Часть 2. Электросвязь и электроника»[5], идентичный международному стандарту IEС 60027-2:2005 «Обозначения буквенные, применяемые в электротехнике. Часть 2. Электросвязь и электроника».
Выглядят они следующим образом:
| Приставка | Аналогичная десятичная приставка | Сокращения по МЭК для битов, байтов | Значение, на которое умножается исходная величина |
|---|---|---|---|
| киби | кило (103) | Кибит, КиБ | 210 = 1024 |
| меби | мега (106) | Мибит, МиБ | 220 = 1 048 576 |
| гиби | гига (109) | Гибит, ГиБ | 230 = 1 073 741 824 |
| теби | тера (1012) | Тибит, ТиБ | 240 = 1 099 511 627 776 |
| пеби | пета (1015) | Пибит, ПиБ | 250 = 1 125 899 906 842 624 |
| эксби | экса (1018) | Эибит, ЭиБ | 260 = 1 152 921 504 606 846 976 |
| зеби | зетта (1021) | Зибит, ЗиБ | 270 = 1 180 591 620 717 411 303 424 |
| йоби | йотта (1024) | Йибит, ЙиБ | 280 = 1 208 925 819 614 629 174 706 176 |
В российском ГОСТ 8.417-2002 («Единицы величин») в приложении А «Единицы количества информации» констатируется факт, что с наименованием «байт» «стандартные» приставки (обозначающие десятичные кратные единицы) используются некорректно, однако, не предлагается никакой альтернативы. Кроме, разве что, обозначения 1 Кбайт = 1024 байт (в отличие от 1 кбайт = 1000 байт).
Более поздний документ, «Положение о единицах величин, допускаемых к применению в Российской Федерации», утверждённое Правительством РФ 31 октября 2009 года, устанавливает, что наименование и обозначение единицы количества информации «байт» (1 байт = 8 бит) применяются с двоичными приставками «Кило», «Мега», «Гига», которые соответствуют множителям 210, 220 и 230 (1 Кбайт = 1024 байт, 1 Мбайт = 1024 Кбайт, 1 Гбайт = 1024 Мбайт). Указанные приставки пишутся с заглавной буквы[6].
Тем же Положением допускается применение и международного обозначения единицы информации с приставками «K» «M» «G» (KB, MB, GB, Kbyte, Mbyte, Gbyte).
Аналогичный стандарт IEEE 1541-2002 введён в 2008 г.
Основной документ Международной системы единиц (СИ) «Брошюра СИ» (фр. Brochure SI, англ. The SI Brochure) подчёркивает, что приставки СИ соответствуют исключительно степеням числа десять, и рекомендует во избежание некорректного использования наименований приставок СИ для двоичных приставок применять наименования, введённые МЭК[7].
Двоичная система счисления имеет широчайшее применение в вычислительной технике. В частности, двоичными числами нумеруются ячейки цифровой памяти. Количество адресов, возможных на некоторой шине, равно 2N, где N — количество её разрядов. Поэтому и микросхемы памяти снабжают количеством ячеек, равным какой-то степени двойки.
Число 210 = 1024 достаточно близко к тысяче, используемой в качестве основания десятичных приставок СИ. Среди степеней двойки вплоть до 293 ни одна больше не близка настолько к степени десяти; к тому же показатель двоичной степени «10» сам по себе оказался удобен для грубого пересчёта двоичных степеней на привычные людям десятичные числа. Для обозначения 210 = 1024 байт придумали единицу «К» (ка, очевидно, искажённое «кило»). В частности, в документации к одной из советских ЭВМ сказано, что объём её памяти 32 К слов. Из-за близости множителей 1024 и 1000 в разговорной речи «К» всё равно называли «кило», и вскоре такая интерпретация приставки кило стала стандартом де-факто, как и экстраполяция на другие приставки: 1 «килобайт» = 1024 байтам, 1 «мегабайт» = 1024 килобайтам = 1 048 576 байтам, и т. д.
Таким образом термины, предназначенные для десятичных приставок СИ, стали применяться к близким двоичным числам. Причём эти приставки часто используют по своему усмотрению, то есть одни понимают их как двоичные приставки, а другие как десятичные. Например, размер оперативной памяти компьютера обычно приводится в двоичных единицах (1 килобайт = 1024 байтам), а размер дисков их производители указывают в десятичных (1 килобайт = 1000 байтам). Однако на письме для множителя 1024 традиционно использовалось сокращение «К», в отличие от «к»=1000, используемого в СИ.
Чем больше число, тем большего значения может достигать ошибка, вызванная неправильным пониманием использованной приставки. В частности, разница между «двоичным» и «десятичным» килобайтом 2,4 %, в то время как между двоичным и десятичным терабайтом — почти 10 % (9,95 %). Для того, чтобы разрешить эту путаницу, и были введены особые двоичные приставки, отличные от «близких» по численному значению десятичных.
Значение приставок согласно стандарту JEDEC[править | править код]
Объединенный инженерный совет по электронным устройствам (англ. Joint Electron Devices Engineering Council, JEDEC), занимающийся разработкой и продвижением стандартов для микроэлектронной промышленности, разработал в 2002 году стандарт JEDEC 100B.01ruen определяющий значения терминов и буквенных символов. Целью данного стандарта является содействие единообразному использованию символов, аббревиатур, терминов и определений в полупроводниковой промышленности. К примеру, спецификация стандарта в качестве единицы измерения количества информации определяет значение приставки K множителем, равным 1024 (210), то есть килобайт обязан быть обозначен как Kbyte или KB и иметь значение, равное 1024 байт.
Спецификация стандарта определяет приставки следующим образом:[8]
- kilo (K): как множитель, равный 1024 (210).
- mega (M): как множитель, равный 1 048 576 (220 или K2, где коэффициент K = 1024).
- giga (G): как множитель, равный 1 073 741 824 (230 или K3, где коэффициент K = 1024).
- tera (T): как множитель, равный 1 099 511 627 776 (240 или K4, где коэффициент K = 1024).
Употребление десятичных приставок (таблица)[править | править код]
| Приставка | Обозначение | Двоичные приставки | Десятичные приставки | Относит. ошибка, % |
|---|---|---|---|---|
| кило | к, k | 210 = 1024 | 103 = 1000 | 2,40 |
| мега | М, M | 220 = 1 048 576 | 106 = 1 000 000 | 4,86 |
| гига | Г, G | 230 = 1 073 741 824 | 109 = 1 000 000 000 | 7,37 |
| тера | Т, T | 240 = 1 099 511 627 776 | 1012 = 1 000 000 000 000 | 9,95 |
| пета | П, P | 250 = 1 125 899 906 842 624 | 1015 = 1 000 000 000 000 000 | 12,59 |
| экса | Э, E | 260 = 1 152 921 504 606 846 976 | 1018 = 1 000 000 000 000 000 000 | 15,29 |
| зетта | З, Z | 270 = 1 180 591 620 717 411 303 424 | 1021 = 1 000 000 000 000 000 000 000 | 18,06 |
| йотта | Й, Y | 280 = 1 208 925 819 614 629 174 706 176 | 1024 = 1 000 000 000 000 000 000 000 000 | 20,89 |
Двоичный подход[править | править код]
Приставки «кило-», «мега-», «гига-» понимаются как двоичные:
- В файловых менеджерах и другом программном обеспечении для сокращённого задания размера файлов. То есть, если программа говорит, что размер файла равен 100 «КБ» (KB), то его размер приблизительно равен 102 400 байт. Однако в некоторых современных файловых менеджерах встречается правильное указание размера файлов (с использованием сокращённой формы производных двоичных приставок, например «КиБ»).
- Производителями полупроводниковой памяти: оперативных запоминающих устройств (ОЗУ), видеопамяти.
- Объём компакт-диска (но не DVD) задаётся именно в двоичных мегабайтах.
- Согласно ГОСТ 8.417-2002, приставку К- (заглавной буквой) применительно к байтам исторически некорректно[9] использовали (и используют) для обозначения 1024 байт. Стандарт, однако, явно не указывает, какое написание единицы «1024 байт» следует считать корректным.
- «Положение о единицах величин, допускаемых к применению в Российской Федерации» устанавливает[6], что наименование и обозначение единицы количества информации «байт» применяются с двоичными приставками «Кило», «Мега» и «Гига», которые соответствуют множителям 210, 220 и 230.
Основные аргументы: традиционное для компьютерной техники использование двоичных кратных, непроизносимость слов типа «гибибайт» или «Гбайт».
Десятичный подход[править | править код]
Приставки «кило-», «мега-», «гига-» понимаются как десятичные:
- Ёмкость жёстких и оптических дисков, SSD-накопителей задаётся именно в десятичных мегабайтах (исключение: компакт-диски, их объём задается в двоичных мегабайтах).
- При неформальном общении (например, про файл в 100 тысяч байт могут сказать «файл в 100 килобайт»).
- При обозначении скоростей телекоммуникационных соединений, например, 100 Мбит/с в стандарте 100BASE-TX («медный» Fast Ethernet) соответствует скорости передачи именно 100 000 000 бит/с, а 10 Гбит/с в стандарте 10GBASE-X (Ten Gigabit Ethernet) — 10 000 000 000 бит/с.
Основные аргументы: Строгое соответствие системе СИ; повсеместное употребление десятичной системы счисления; завышение объёма носителей при помощи более мелкой единицы («коммерческие мегабайты»).
Применяемое в телекоммуникациях понятие «килобит» означает тысячу битов (по ГОСТ 8.417-2002). Впрочем, из-за влияния «килобайта» некоторые люди и организации для однозначности употребляют вместо «килобита» выражение «тысяча бит».
Иное[править | править код]
Ёмкость трёхдюймовой дискеты на 1,44 МБ (включая служебные данные — загрузочный сектор, корневой каталог и FAT) задаётся в двоично-десятичных мегабайтах. Один такой «мегабайт» равняется 1000 КиБ (≈ 0,977 МиБ), но при этом 1 КиБ равен 1024 байтам.
То есть, фактически, вместимость трёхдюймовой дискеты равна 1440 кибибайтам, или же 1 474 560 байтам (из которых для записи доступны 1 457 664). Аналогично, трёхдюймовая дискета на 2,88 МБ в действительности вмещает 2880 кибибайт, или же 2 949 120 байт.
Ёмкость флэш-карт памяти и USB-флэшек — это полная ёмкость микросхемы (двоичная) минус технический объём, который может быть больше или меньше. Соответственно, неформатированная ёмкость флэшки — очень приблизительно десятичная (обычно несколько больше).
| Степени | |
|---|---|
| Традиционные битовые единицы | |
| Традиционные байтовые единицы | |
Дважды два — пять — Википедия
«Арифметика встречного промфинплана: 2 + 2 + энтузиазм рабочих = 5» — советский агитационный плакат, призывающий к выполнению пятилетнего плана за четыре года. Художник Яков Гуминер, 1931 год.Выражение «дважды два — пять» (реже, 2 + 2 = 5) иногда используется как краткое и яркое представление нелогичного утверждения, особенно такого, которое утверждается и поддерживается с целью соответствия идеологическому порядку.
Использование происходит от его включения Джорджем Оруэллом в роман «1984», но Оруэлл взял[1] фразу из названия одной из глав книги Юджина Лайона «Командировка в утопию», где оно использовано как лозунг во время завершения пятилетнего плана в СССР в четыре года.
В романе «1984» (часть I, глава VII), выражение контрастирует с правильным математическим равенством 2 + 2 = 4. Оруэлловский герой, Уинстон Смит, использует выражение в рассуждении о вопросе, может ли Государство декларировать «дважды два — пять» (в оригинале — 2 + 2 = 5) как факт; он обдумывает мысль: если каждый поверит в него, сделает ли это его истинным? Смит пишет: «Свобода — это возможность сказать, что дважды два — четыре. Если дозволено это, все остальное отсюда следует».
Позже в романе Смит пытается воспользоваться двоемыслием, чтобы научить себя, что выражение «дважды два — пять» — истинное или как минимум такое же истинное, как и любой другой результат, который любой может предложить.
По мнению В. А. Чаликовой, прообразом выражения послужил расхожий советский лозунг «Пятилетка в четыре года»[2]. При этом Чаликова отмечает, что впервые
<…> тема «здравого арифметического смысла» звучит у Оруэлла со времён гражданской войны в Испании, когда перед ним впервые встаёт видение «кошмарного мира, где дважды два будет столько, сколько скажет вождь. Если он скажет „пять“, значит, так и есть, пять».
Сама формула 2 × 2 = 5 распространена в литературе (у Достоевского («Записки из подполья»), Энгельса[3], Пруста,[источник не указан 561 день]Честертона,[источник не указан 561 день]Бретона,[источник не указан 561 день]Замятина[источник не указан 561 день]), однако до Оруэлла обычно применялась для иллюстрации «тирании рассудка» (так, «подпольный человек» отказывается от мира, где дважды два четыре, и говорит, что «дважды два пять — премилая иногда вещичка»). Оруэлл же отрицал такой агрессивный отказ от «обычной порядочности».
Впрочем, и формула «дважды два — пять» как символ подавления свободы использовалась в литературе и ранее, например: «Он вооружил далее негров и диких индейцев, чтобы и они преследовали бедных американцев без пощады, пока те не признают, как этого требует их король, что дважды два пять» (П. Г. Мижуев, 1901).
В 1895 году французский писатель-абсурдист Альфонс Алле опубликовал один из самых популярных своих сборников рассказов, который так и назывался: «Два и два — пять (2+2=5)» (Paris, Ollendorff, 1895). В русском переводе парадоксальность этой фразы дополнительно усилена: «Дважды два — почти пять».[4]
Известный русский писатель-футурист Вадим Шершеневич в 1920 году почти так же («2 × 2 = 5») озаглавил свою программную книгу, посвящённую современному искусству.[5]
Подобные нелогичные формулы также широко используются в рекламе, с целью показать наличие скидок, например «вы платите за 4, а получаете 5».



 (
(