Слепота – статьи о здоровье
Слепотой называют выраженную степень аномалий нарушения зрения. Слепота – болезнь, характеризующаяся полным отсутствием зрения или его значительным снижением.
При слепоте становится невозможным либо ограниченным зрительное восприятие, что обусловлено значимым сужением поля зрения, со снижением остроты центрального зрения.
Принято различать тотальную (абсолютную) и практическую слепоту.
Полная слепота является состоянием, при котором зрительные ощущения на оба глаза отсутствуют абсолютно. Практической слепоте присуще остаточное зрение, а также сохраняющиеся цвето- и светоощущение.
Почему человек слепнет?
Внезапная слепота не возникает у людей с абсолютно здоровым организмом. Данная патология является следствием наличия таких заболеваний и состояний, как:
- Диабетическая ретинопатия;
- Дегенерация зрительного пятна;
- Глаукома;
- Катаракта;
- Онхоцеркоз;
- Трахома;
- Кератомаляция и ксерофтальмия;
- Травма.

Врожденная слепота зависит от внутриутробных заболеваний или пороков развития плода.
На первом месте в статистике причин приобретенной слепоты стоит глаукома, на втором -трахома, на третьем — травмы глаз. Случаи слепоты от болезней роговицы, зрительного нерва и сетчатки наблюдаются реже.
Чаще потеря зрения отмечается в возрасте до 10 лет и старше 50 лет. Это объясняется тем, что у детей выявляется врожденная слепота и наблюдается потеря зрения от распространенных в детском возрасте глазных, и общих заболеваний, а также травм глаз. У лиц старше 50 лет причиной слепоты являются глаукома и сосудистые заболевания.
Симптомы
Слепыми считаются люди, у которых отсутствуют зрительные ощущения. При этом, у них может быть светоощущение и остаточное зрение на глазу, который лучше видит в пределах 0,01 — 0,05D с коррекцией очками или контактными линзами.
Люди со слепотой не могут воспринимать цвет, форму, размер предметов и их расположение в пространстве. Поэтому им трудно ориентироваться в пространстве, происходит задержка формирования движений. При этом у слепых людей усилена ориентировочная реакция на звук.
Поэтому им трудно ориентироваться в пространстве, происходит задержка формирования движений. При этом у слепых людей усилена ориентировочная реакция на звук.
Потеря зрения может быть резкой или происходит постепенно, если причиной является заболевание.
Диагностика
Чтобы установить, полностью ли отсутствует зрение, выявить широты полей зрения, а также цветовое зрение, есть ли возможность скорректировать проблему с помощью линз, очков, оперативного вмешательства, необходимо пройти детальное обследование в офтальмологическом центре.
При подозрении на приобретенную потерю зрения необходимо установить локализацию патологического очага (офтальмологический осмотр — биомикроскопия, офтальмоскопия). При некоторых формах патологии сетчатки снижение зрения может проявиться еще до манифестации морфологических изменений сетчатки. При подозрении на атрофию зрительного нерва, особенно асимметричного или одностороннего характера, требуется проведение КТ или МРТ головного мозга.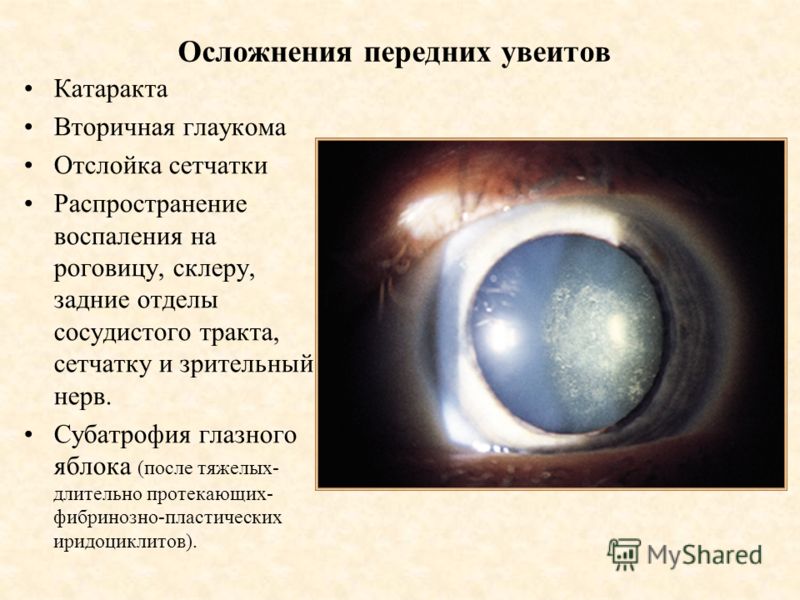
Можно ли вылечить слепоту?
Некоторые виды полной слепоты являются обратимыми. В частности, зрение, утраченное из-за катаракты, воспалительных и инфекционных заболеваний, восстанавливается после лечения основного заболевания. При острой потере зрения (например, при отслойке сетчатки) возможно проведение хирургического или лазерного лечения.
Лечение зависит от причины, вызвавшей слепоту. Если причиной является нарушение функций зрительного нерва, либо отсутствие зрения вызвано кровоизлиянием в мозг, обычно вернуть зрение невозможно. Пациент нуждается в психологической помощи и в обучении передвижению без контроля зрения.
Современным достижением в лечении слепоты является искусственная зрительная система «бионический глаз».
Слепота – статьи о здоровье
Слепотой называют выраженную степень аномалий нарушения зрения. Слепота – болезнь, характеризующаяся полным отсутствием зрения или его значительным снижением.
При слепоте становится невозможным либо ограниченным зрительное восприятие, что обусловлено значимым сужением поля зрения, со снижением остроты центрального зрения.
Принято различать тотальную (абсолютную) и практическую слепоту.
Полная слепота является состоянием, при котором зрительные ощущения на оба глаза отсутствуют абсолютно. Практической слепоте присуще остаточное зрение, а также сохраняющиеся цвето- и светоощущение.
Почему человек слепнет?
Внезапная слепота не возникает у людей с абсолютно здоровым организмом. Данная патология является следствием наличия таких заболеваний и состояний, как:
- Диабетическая ретинопатия;
- Дегенерация зрительного пятна;
- Глаукома;
- Катаракта;
- Онхоцеркоз;
- Трахома;
- Кератомаляция и ксерофтальмия;
- Травма.
Врожденная слепота зависит от внутриутробных заболеваний или пороков развития плода.
На первом месте в статистике причин приобретенной слепоты стоит глаукома, на втором -трахома, на третьем — травмы глаз. Случаи слепоты от болезней роговицы, зрительного нерва и сетчатки наблюдаются реже.
Чаще потеря зрения отмечается в возрасте до 10 лет и старше 50 лет. Это объясняется тем, что у детей выявляется врожденная слепота и наблюдается потеря зрения от распространенных в детском возрасте глазных, и общих заболеваний, а также травм глаз. У лиц старше 50 лет причиной слепоты являются глаукома и сосудистые заболевания.
Это объясняется тем, что у детей выявляется врожденная слепота и наблюдается потеря зрения от распространенных в детском возрасте глазных, и общих заболеваний, а также травм глаз. У лиц старше 50 лет причиной слепоты являются глаукома и сосудистые заболевания.
Симптомы
Слепыми считаются люди, у которых отсутствуют зрительные ощущения. При этом, у них может быть светоощущение и остаточное зрение на глазу, который лучше видит в пределах 0,01 — 0,05D с коррекцией очками или контактными линзами.
Люди со слепотой не могут воспринимать цвет, форму, размер предметов и их расположение в пространстве. Поэтому им трудно ориентироваться в пространстве, происходит задержка формирования движений. При этом у слепых людей усилена ориентировочная реакция на звук.
Потеря зрения может быть резкой или происходит постепенно, если причиной является заболевание.
Диагностика
Чтобы установить, полностью ли отсутствует зрение, выявить широты полей зрения, а также цветовое зрение, есть ли возможность скорректировать проблему с помощью линз, очков, оперативного вмешательства, необходимо пройти детальное обследование в офтальмологическом центре.
При подозрении на приобретенную потерю зрения необходимо установить локализацию патологического очага (офтальмологический осмотр — биомикроскопия, офтальмоскопия). При некоторых формах патологии сетчатки снижение зрения может проявиться еще до манифестации морфологических изменений сетчатки. При подозрении на атрофию зрительного нерва, особенно асимметричного или одностороннего характера, требуется проведение КТ или МРТ головного мозга.
Можно ли вылечить слепоту?
Некоторые виды полной слепоты являются обратимыми. В частности, зрение, утраченное из-за катаракты, воспалительных и инфекционных заболеваний, восстанавливается после лечения основного заболевания. При острой потере зрения (например, при отслойке сетчатки) возможно проведение хирургического или лазерного лечения.
Лечение зависит от причины, вызвавшей слепоту. Если причиной является нарушение функций зрительного нерва, либо отсутствие зрения вызвано кровоизлиянием в мозг, обычно вернуть зрение невозможно. Пациент нуждается в психологической помощи и в обучении передвижению без контроля зрения.
Пациент нуждается в психологической помощи и в обучении передвижению без контроля зрения.
Современным достижением в лечении слепоты является искусственная зрительная система «бионический глаз».
Четыре технологии, которые могут изменить лечение слепоты
Во всем мире 36 миллионов человек полностью потеряли зрение 1 . Они не могут видеть формы или даже источники света. Для большинства этих людей слепота связана с излечимыми проблемами, такими как катаракта, — у них просто нет доступа к надлежащему медицинскому обслуживанию. Остальные миллионы, однако, слепы в результате заболеваний, которые в настоящее время не поддаются эффективному лечению.
Часть Nature Outlook: Глаз
«Слепота — это одно из самых опасных состояний, с которыми может столкнуться человек, — говорит Уильям Хаусвирт, офтальмолог из Университета Флориды в Гейнсвилле. Помимо трудностей, связанных с мобильностью и поиском работы, нарушение зрения связано с множеством других проблем со здоровьем, включая бессонницу, беспокойство и депрессию и даже риск самоубийства.
В странах с высоким уровнем дохода, где регулярно устраняются предотвратимые причины ухудшения зрения, ведущей причиной слепоты является дегенерация сетчатки. Эта ткань, расположенная в задней части глаза, содержит специализированные клетки, которые реагируют на свет и обрабатывают визуальные сигналы и поэтому имеют решающее значение для зрения. Фоторецепторные клетки — нейроны, широко известные как палочки и колбочки, — преобразуют свет, попадающий на сетчатку, в электрохимические сигналы. Эти сигналы затем фильтруются через сложную сеть других нейронов, включая биполярные клетки, амакриновые клетки и горизонтальные клетки, прежде чем достичь нейронов, известных как ганглиозные клетки сетчатки. Длинные отростки, или аксоны, этих клеток образуют зрительный нерв, по которому сигналы от сетчатки передаются в зрительную кору головного мозга, где они интерпретируются как изображения.
Заболевания сетчатки обычно связаны с потерей фоторецепторных клеток, что снижает чувствительность глаза к свету. При некоторых заболеваниях сетчатки, включая возрастную дегенерацию желтого пятна (AMD), эта потеря возникает в результате отказа эпителиальных клеток, которые образуют слой в задней части сетчатки, известный как пигментный эпителий сетчатки (RPE). RPE поддерживает здоровье фоторецепторных клеток, очищая токсичные побочные продукты, образующиеся во время реакции со светом, а также обеспечивая питательные вещества. При заболеваниях сетчатки, при которых фоторецепторы остаются в хорошем состоянии, основной причиной слепоты является дегенерация ганглиозных клеток сетчатки.
Прослушать аудиоверсию этой статьи
Ваш браузер не поддерживает аудио элементы.Скачать MP3
Разнообразие причин ухудшения зрения затрудняет поиск решений. Но достижения в нескольких областях вселяют надежду на то, что почти все формы заболеваний сетчатки можно будет лечить.
Один из подходов заключается в дополнении или обходе поврежденных глаз функциональными протезами. Такие бионические глаза в настоящее время могут восстанавливать лишь ограниченное зрение, но исследователи продолжают расширять возможности устройств. Другой вариант — генная терапия. Уже доступный для людей с определенными генетическими мутациями, исследователи стремятся распространить этот подход на большее количество людей и состояний. Некоторые ученые также проводят лечение, основанное на родственном методе, известном как оптогенетика, который включает генетическое изменение клеток для восстановления светочувствительности сетчатки. Эта работа находится на ранней стадии, но исследователи надеются, что подход в конечном итоге сможет помочь широкому кругу людей, поскольку он не зависит от причин дегенерации сетчатки. И усилия по замене утраченных или поврежденных клеток сетчатки либо in situ или с помощью клеточных трансплантатов намекают на то, что даже заболевания сетчатки на поздних стадиях могут в конечном итоге стать излечимыми.
Большая часть этих исследований находится в зачаточном состоянии. Но Хаусвирт с оптимизмом смотрит на уже достигнутый прогресс. Десять лет назад, говорит он, ему часто приходилось говорить пациентам, что он ничего не может для них сделать. «Для многих из этих болезней это полностью изменилось».
Бионические глаза
Почти 30 лет назад Марк Хумаюн, инженер-биомедик из Университета Южной Калифорнии в Лос-Анджелесе, начал электрическую стимуляцию сетчатки слепых людей. Работая с коллегами из Second Sight Medical Products, медицинской технологической фирмы в Сильмаре, штат Калифорния, его эксперименты показали, что такая стимуляция может вызывать визуальное восприятие пятен света, называемых фосфенами. После десяти лет работы на животных по установлению количества электрического тока, которое можно безопасно приложить к глазу, и вооружившись значительно расширившимися знаниями о количестве и типах клеток, сохраняющихся в дегенерирующей сетчатке человека, команда Хумаюна была готова приступить к работе. с людьми. В период с 2002 по 2004 год исследователи имплантировали бионический глаз каждому из шести человек с полной или почти полной слепотой на один глаз — первое испытание такого рода. Получатели устройства, известного как Argus I, сообщили, что способны воспринимать фосфены, направленное движение и даже формы 9.0003 2
с людьми. В период с 2002 по 2004 год исследователи имплантировали бионический глаз каждому из шести человек с полной или почти полной слепотой на один глаз — первое испытание такого рода. Получатели устройства, известного как Argus I, сообщили, что способны воспринимать фосфены, направленное движение и даже формы 9.0003 2
Имплантат Argus II состоит из массива электродов, прикрепленных к поверхности сетчатки. Фото: Ringo Chiu/ZUMA/Alamy
Чтобы установить Argus II, пациентам проводят операцию по прикреплению чипа, содержащего массив электродов, к поверхности сетчатки.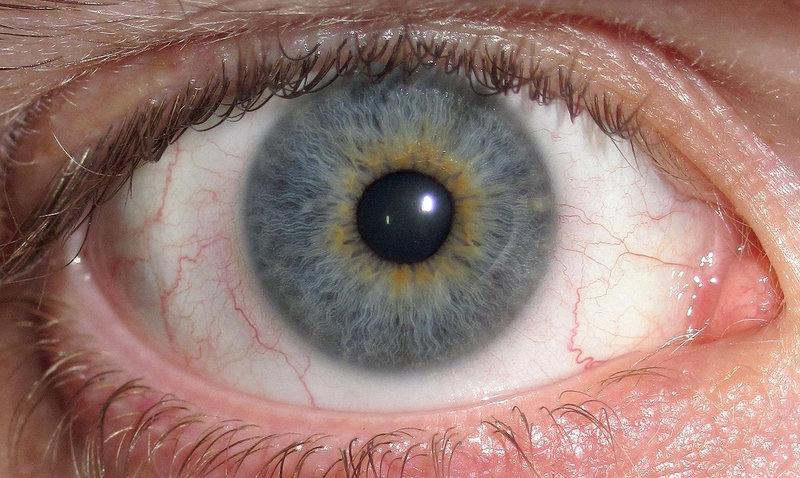 Чтобы «видеть» с помощью устройства, миниатюрная видеокамера, установленная на очках, передает сигналы на процессор, который носит получатель. Процессор преобразует сигналы в инструкции, которые передаются по беспроводной связи на имплантированное устройство. Затем электроды стимулируют ганглиозные клетки сетчатки в передней части сетчатки. Использование протеза — это процесс обучения. Получатели должны тренировать свой мозг, чтобы интерпретировать новый тип получаемой информации. А поскольку видеокамера не отслеживает движения глаз, они также должны научиться двигать головой, чтобы направлять взгляд.
Чтобы «видеть» с помощью устройства, миниатюрная видеокамера, установленная на очках, передает сигналы на процессор, который носит получатель. Процессор преобразует сигналы в инструкции, которые передаются по беспроводной связи на имплантированное устройство. Затем электроды стимулируют ганглиозные клетки сетчатки в передней части сетчатки. Использование протеза — это процесс обучения. Получатели должны тренировать свой мозг, чтобы интерпретировать новый тип получаемой информации. А поскольку видеокамера не отслеживает движения глаз, они также должны научиться двигать головой, чтобы направлять взгляд.
Устройство обеспечивает лишь ограниченный обзор. Пользователи могут обнаруживать источники света и объекты с высококонтрастными краями, такие как двери или окна, а некоторые могут расшифровывать большие буквы. Эти ограничения возникают отчасти из-за того, что 60 электродов устройства обеспечивают очень низкое разрешение по сравнению с миллионами фоторецепторных клеток в здоровом глазу.
В то время как Argus II является эпиретинальным имплантатом, то есть он располагается на поверхности сетчатки, другие разрабатываемые устройства предназначены для размещения под сетчаткой. Эти субретинальные имплантаты могут стимулировать клетки, более близкие к тем, которые обычно передают сигналы сетчатке — фоторецепторные клетки. Стимулируя клетки, расположенные выше зрительного пути, исследователи надеются сохранить большую часть обработки сигналов, которая выполняется здоровой сетчаткой.
Retina Implant, биотехнологическая компания, базирующаяся в Ройтлингене, Германия, создала субретинальный имплантат, содержащий фотодиоды (полупроводниковые устройства, преобразующие свет в электрический ток), которые непосредственно воспринимают свет, попадающий в глаз.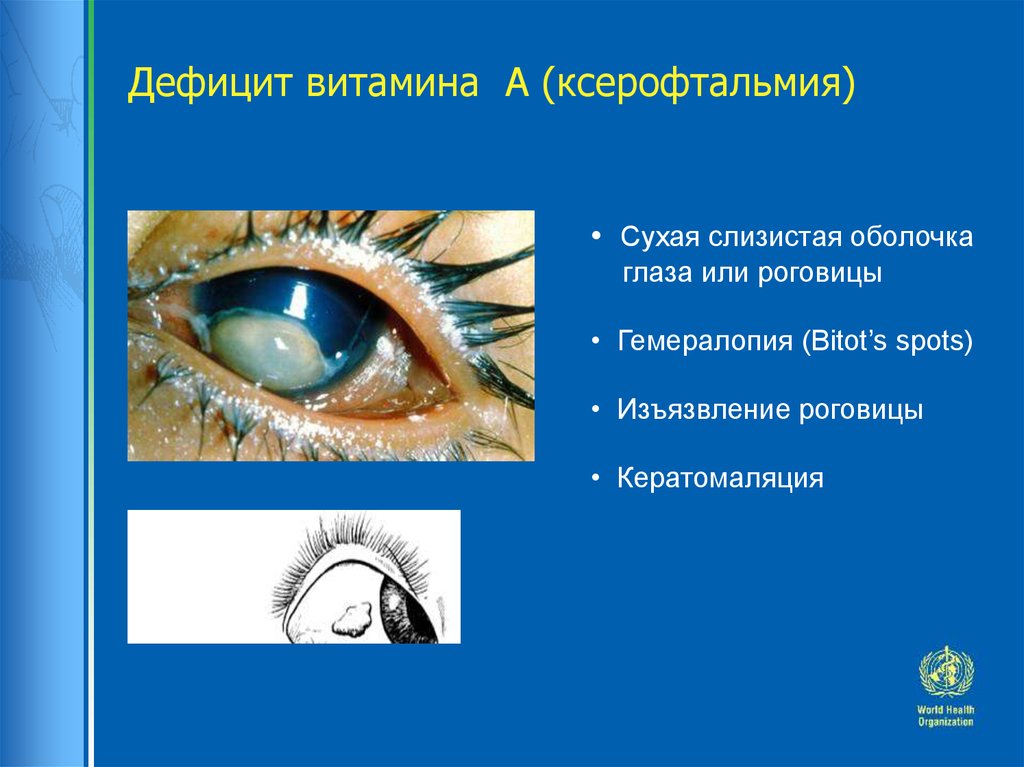
Pixium Vision в Париже тестирует фотогальванический субретинальный имплантат под названием Prima. Система проецирует сигналы с видеокамеры, установленной на очках, в глаз, используя ближний инфракрасный свет, длина волны которого оптимизирует работу фотодиодов в устройстве для стимуляции клеток сетчатки. Проецирование изображений таким образом дает пользователям некоторый контроль над направлением их взгляда, потому что они могут исследовать сцену, двигая только глазами. Питание также обеспечивается ближним инфракрасным светом, что делает имплантат беспроводным и делает операцию по его установке менее сложной. «Пациенты учатся быстрее восстанавливать зрение, и разрешение кажется лучше», — говорит Хосе-Ален Сахель, офтальмолог из Университета Питтсбурга, штат Пенсильвания, который проводит испытания безопасности устройства на десяти людях с ВМД. «Это первые дни, но это очень многообещающе».
«Это первые дни, но это очень многообещающе».
Все эти устройства работают только тогда, когда в сетчатке остаются функционирующие клетки. При распространенных заболеваниях глаз, поражающих в основном фоторецепторные клетки, включая пигментный ретинит и ВМД, обычно остается некоторое количество клеток для стимуляции. Но когда погибает слишком много ганглиозных клеток сетчатки, как это происходит при запущенной диабетической ретинопатии и глаукоме, такие имплантаты не могут помочь. Для людей без каких-либо оставшихся функций сетчатки, будь то из-за болезни или травмы, альтернативный бионический подход может быть более актуальным.
Хумаюн и его коллеги работают над системой, которая обходит глаза, отправляя сигналы прямо в мозг. Идея не нова: в 1970-х годах американский инженер-биомедик Уильям Добель показал, что прямая стимуляция зрительной коры запускает восприятие фосфенов 3 . Но технология бионического глаза только сейчас догоняет. Компания Second Sight разработала систему Orion, которая, по словам Хумаюна, «в основном представляет собой модифицированный Argus II».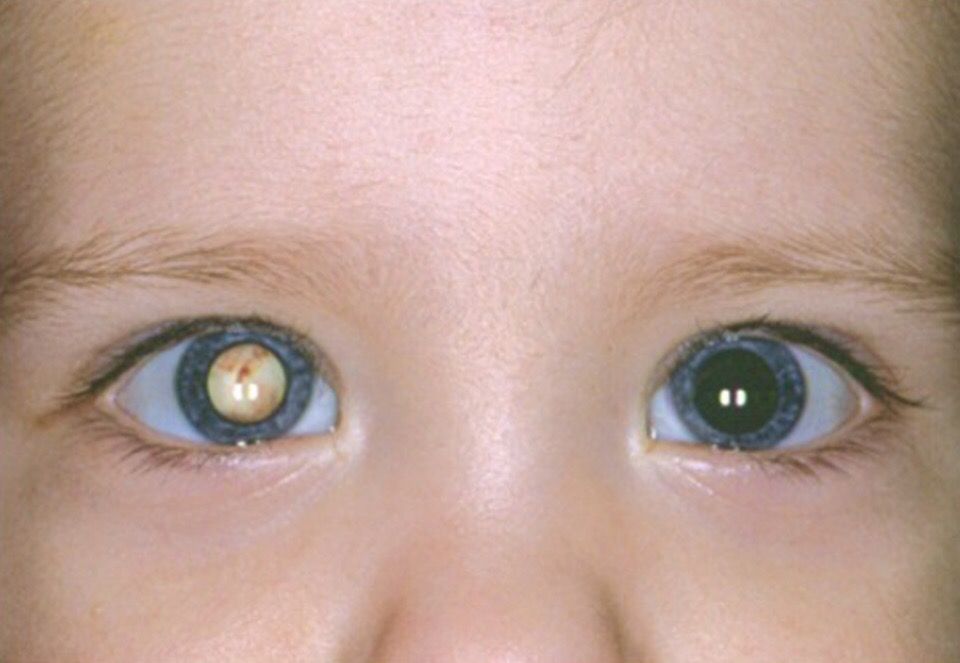 Как и в оригинале, в нем используются видеокамера и сигнальный процессор, которые связываются с имплантатом по беспроводной связи, но чип размещается на поверхности зрительной коры, а не на сетчатке. Устройство тестируется на пяти людях с ограниченным или отсутствующим светоощущением из-за травмы глаза или повреждения сетчатки или зрительного нерва. «Пока результаты хорошие, — говорит он. — Нас пока ничему не удивишь.
Как и в оригинале, в нем используются видеокамера и сигнальный процессор, которые связываются с имплантатом по беспроводной связи, но чип размещается на поверхности зрительной коры, а не на сетчатке. Устройство тестируется на пяти людях с ограниченным или отсутствующим светоощущением из-за травмы глаза или повреждения сетчатки или зрительного нерва. «Пока результаты хорошие, — говорит он. — Нас пока ничему не удивишь.
Учитывая, что некоторые технологии уже испытаны на людях, Хумаюн надеется, что система может получить одобрение регулирующих органов в течение нескольких лет. «Очевидно, что операции на головном мозге сопряжены с другим уровнем риска, но процедура довольно проста, и Orion может помочь гораздо большему количеству пациентов», — говорит он. Однако гораздо меньше известно о стимуляции мозга для обеспечения полезного зрения. «Мы много знаем о сетчатке, но очень мало о коре», — говорит Ботонд Роска, нейробиолог из Базельского института молекулярной и клинической офтальмологии в Швейцарии. «Но мы никогда не узнаем достаточно, если не попробуем», — говорит он.
«Но мы никогда не узнаем достаточно, если не попробуем», — говорит он.
Генная терапия
Глаз является идеальной мишенью для генной терапии. Поскольку он относительно автономен, вирусы, которые используются для переноса генов в клетки сетчатки, не должны иметь возможности перемещаться в другие части тела. А поскольку глаз является иммунопривилегированным участком, иммунная система с меньшей вероятностью выстроит там защиту от такого вируса.
Офтальмолог Альберт Магуайр осматривает глаза девочки с врожденным амаврозом Лебера, чье зрение было восстановлено с помощью генной терапии voretigene neparvovec (Luxturna). Предоставлено: Детская больница Филадельфии
Во время первой демонстрации потенциала генной терапии для борьбы со слепотой три группы исследователей использовали этот метод для успешного лечения людей с врожденным амаврозом Лебера (ВЛА). Это наследственное заболевание приводит к тяжелым нарушениям зрения и начинается в первые несколько лет жизни, часто проявляясь ночной слепотой, а затем прогрессирует до полной потери зрения, которая начинается на периферии поля зрения. Он поражает примерно 1 из 40 000 детей.
Он поражает примерно 1 из 40 000 детей.
Исследователи намеревались заняться конкретной формой заболевания, известной как LCA 2. Это вызвано мутациями в RPE65 , ген, который экспрессируется RPE. Мутировавший ген отрицательно влияет на функцию РПЭ, что, в свою очередь, повреждает фоторецепторные клетки. В 2008 году три команды, в том числе одна под руководством Хаусвирта, показали в клинических испытаниях на ранней стадии, что доставка здоровой копии RPE65 в сетчатку была безопасной и приводила к ограниченному улучшению зрения 4 , 5 , 6 . Клинические испытания фазы III под руководством Альберта Магуайра, офтальмолога из Пенсильванского университета в Филадельфии, показали в августе 2017 года, что люди с LCA 2, которые получали лечение, лучше преодолевали препятствия при различных уровнях освещения, чем те, кто этого не делал. 7 . В декабре 2017 года FDA одобрило лечение voretigene neparvovec (Luxturna), что сделало его первой генной терапией для любого состояния, получившей зеленый свет для клинического применения.
Таким способом можно лечить LCA 2, поскольку вовлеченные генетические мутации демонстрируют рецессивный тип наследования. Это означает, что обе копии RPE65 человека должны нести соответствующие мутации, чтобы вызвать заболевание. Таким образом, предоставление одной неизмененной версии решает проблему. Однако состояния, вызванные доминантно унаследованными мутациями, требуют для проявления только одной мутировавшей копии гена. В большинстве из них простое добавление нормальной копии гена не поможет; вместо этого мутировавший ген должен быть инактивирован. Один из вариантов — заставить его замолчать, добавив определенные молекулы РНК, которые перехватывают инструкции мутировавшего гена по созданию неисправного белка, а затем снабдить нормальную копию гена, которая возьмет на себя его обязанности — подход, называемый подавлением и замещением. Другой — исправить мутацию с помощью техники редактирования генов CRISPR–Cas9.. Исследователи из Университета Модены и Реджо-Эмилии в Модене, Италия, продемонстрировали этот подход на мышиной модели пигментного ретинита 8 в 2016 году. В следующем году команда из США использовала его для исправления мутации, вызывающей тип глаукомы как у мышей, так и в культуре клеток человека 9 .
В следующем году команда из США использовала его для исправления мутации, вызывающей тип глаукомы как у мышей, так и в культуре клеток человека 9 .
Важным фактором прогресса генной терапии стало использование аденоассоциированного вируса (AAV) для доставки замещающих генов в клетки. Было показано, что AAV безопасны отчасти потому, что они, как правило, не интегрируются в геном своей клетки-хозяина, что сводит к минимуму риск превращения клеток в раковые. А их небольшой размер позволяет им широко диффундировать через глаз и, следовательно, заражать большое количество клеток. Но способность AAV доставлять гены имеет ограничения: некоторые гены просто слишком велики для AAV, в том числе ABCA4 , мутации в котором могут привести к болезни Штаргардта, наследственной форме дегенерации желтого пятна. В настоящее время рассматриваются два обходных пути. Первый использует вирус с большей пропускной способностью, такой как лентивирус, для доставки замещающих генов. Безопасность и эффективность этого подхода неизвестны, но клинические испытания продолжаются. Вторая стратегия состоит в том, чтобы разбить замещающий ген на две части и транспортировать каждую половину отдельно в клетку вместе со средствами их рекомбинации. «Сейчас это работает как минимум на одной модели животных», — говорит Хаусвирт.
Вторая стратегия состоит в том, чтобы разбить замещающий ген на две части и транспортировать каждую половину отдельно в клетку вместе со средствами их рекомбинации. «Сейчас это работает как минимум на одной модели животных», — говорит Хаусвирт.
Независимо от подхода генная терапия имеет значительные ограничения. Более 250 генов связаны со слепотой, и поскольку на каждый из них могут воздействовать многочисленные типы мутаций, количество потенциальных терапевтических мишеней огромно. Например, более 100 мутаций в гене RHO приводят к пигментному ретиниту, наиболее распространенному доминантно наследуемому заболеванию сетчатки. По словам Хаусвирта, разработка генной терапии для каждой мутации нецелесообразна.
Исследователи работают над потенциальным решением, которое изменяет подход подавления и замены. Вместо нацеливания на копии RHO , содержащие определенную мутацию, они используют сайленсинговую РНК для подавления всей экспрессии гена, независимо от того, мутирован ли RHO или нет, при этом доставляя замещающую копию, которая невосприимчива к сайленсинговой РНК. Группа под руководством Джейн Фаррар, генетика из Тринити-колледжа в Дублине, продемонстрировала перспективность этой стратегии в 2011 году на мышиной модели доминантного пигментного ретинита 9.0003 10 . В 2018 году Хаусвирт и его коллеги протестировали этот подход на собаках с пигментным ретинитом 11 . Они показали, что дегенерацию фоторецепторных клеток в обработанных участках сетчатки можно остановить — улучшение, которое сохранялось в течение как минимум восьми месяцев. Эта стратегия устраняет все мутации, которые могут вызывать пигментный ретинит с доминантным наследством, за одно лечение и, следовательно, расширяет генную терапию от рецессивных до доминантно наследуемых состояний «довольно простым способом», говорит Хаусвирт. Он планирует изучить, насколько хорошо собаки, получившие лечение, могут ориентироваться в лабиринте, и собирает данные о безопасности, необходимые для начала клинических испытаний.
Группа под руководством Джейн Фаррар, генетика из Тринити-колледжа в Дублине, продемонстрировала перспективность этой стратегии в 2011 году на мышиной модели доминантного пигментного ретинита 9.0003 10 . В 2018 году Хаусвирт и его коллеги протестировали этот подход на собаках с пигментным ретинитом 11 . Они показали, что дегенерацию фоторецепторных клеток в обработанных участках сетчатки можно остановить — улучшение, которое сохранялось в течение как минимум восьми месяцев. Эта стратегия устраняет все мутации, которые могут вызывать пигментный ретинит с доминантным наследством, за одно лечение и, следовательно, расширяет генную терапию от рецессивных до доминантно наследуемых состояний «довольно простым способом», говорит Хаусвирт. Он планирует изучить, насколько хорошо собаки, получившие лечение, могут ориентироваться в лабиринте, и собирает данные о безопасности, необходимые для начала клинических испытаний.
Оптогенетика
Генная терапия работает только у людей, чья слепота вызвана генетической мутацией. Он также не подходит для лечения терминальной стадии заболевания сетчатки, при котором остается недостаточное количество клеток для восстановления. Но родственный подход, основанный на методе, называемом оптогенетикой, не зависит от расстройства и может привести к лечению различных стадий дегенерации. В оптогенетике гены, которые позволяют клеткам производить светочувствительные белки, известные как опсины, доставляются вирусом. Введение опсинов может восстановить некоторую светочувствительность поврежденных фоторецепторов или даже сделать другие клетки сетчатки, включая биполярные клетки или ганглиозные клетки сетчатки, чувствительными к свету.
Он также не подходит для лечения терминальной стадии заболевания сетчатки, при котором остается недостаточное количество клеток для восстановления. Но родственный подход, основанный на методе, называемом оптогенетикой, не зависит от расстройства и может привести к лечению различных стадий дегенерации. В оптогенетике гены, которые позволяют клеткам производить светочувствительные белки, известные как опсины, доставляются вирусом. Введение опсинов может восстановить некоторую светочувствительность поврежденных фоторецепторов или даже сделать другие клетки сетчатки, включая биполярные клетки или ганглиозные клетки сетчатки, чувствительными к свету.
Оптогенетика использовалась для восстановления светочувствительности колбочек (зеленые) в мышиной модели пигментного ретинита; Успех метода оценивался путем измерения активности ганглиозной клетки сетчатки (пурпурного цвета), которая стимулируется колбочками в ответ на свет. Кредит: IOB.ch
Проблематична, однако, в то время как фоторецепторные клетки в глазу могут справляться с широким диапазоном интенсивности света — хорошо работая как при ярком солнечном свете, так и в сумерках — опсины имеют ограниченный диапазон и часто лучше работают при высокой интенсивности света. Потенциальное решение состоит в том, чтобы использовать установку, которая работает аналогично системе бионического глаза Pixium Vision Prima, в которой реципиенты надевают очки, включающие видеокамеру, фиксирующую взгляд пользователя, и проектор, направленный ему в глаз. . Как и в случае с Prima, преимущество заключается в том, что характер света, попадающего в глаз, можно адаптировать к модификации сетчатки; однако в этом случае выбранные интенсивность и длина волны лучше всего управляют вновь введенными опсинами, а не имплантированными фотодиодами.
Потенциальное решение состоит в том, чтобы использовать установку, которая работает аналогично системе бионического глаза Pixium Vision Prima, в которой реципиенты надевают очки, включающие видеокамеру, фиксирующую взгляд пользователя, и проектор, направленный ему в глаз. . Как и в случае с Prima, преимущество заключается в том, что характер света, попадающего в глаз, можно адаптировать к модификации сетчатки; однако в этом случае выбранные интенсивность и длина волны лучше всего управляют вновь введенными опсинами, а не имплантированными фотодиодами.
GenSight Biologics, парижская биотехнологическая компания, среди основателей которой Сахель и Рошка, уже тестирует такую систему. Он направлен на доставку опсина к ганглиозным клеткам сетчатки, но есть потенциальная загвоздка: ганглиозные клетки сетчатки естественным образом чувствительны к свету. Они экспрессируют меланопсин, белок, участвующий в зрачковом рефлексе на свет, при котором зрачок глаза сужается в ответ на яркий свет. Чтобы избежать этого, исследователи из GenSight используют опсин, реагирующий на красные длины волн света, потому что меланопсин преимущественно реагирует на свет в синей части спектра. В октябре 2018 года компания начала клинические испытания на ранней стадии у людей с прогрессирующим пигментным ретинитом, у которых осталось минимальное зрение. В испытании примут участие когорты из Великобритании, Франции и США, а первые результаты ожидаются к концу 2020 г.
Чтобы избежать этого, исследователи из GenSight используют опсин, реагирующий на красные длины волн света, потому что меланопсин преимущественно реагирует на свет в синей части спектра. В октябре 2018 года компания начала клинические испытания на ранней стадии у людей с прогрессирующим пигментным ретинитом, у которых осталось минимальное зрение. В испытании примут участие когорты из Великобритании, Франции и США, а первые результаты ожидаются к концу 2020 г.
«Это простой подход, и мы должны посмотреть, что получится», — говорит Рошка. «Затем мы можем перейти ко все более и более сложным подходам». Одна остающаяся проблема заключается в том, что многие нарушения, которые можно лечить с помощью оптогенетических методов, связаны с дегенерацией определенных частей сетчатки, при этом полезное зрение сохраняется в других областях. Свет, управляющий опсинами, виден и может мешать естественному зрению. В будущем опсины, реагирующие на ближний инфракрасный свет, могут позволить оптогенетическим методам лечения работать в тандеме с остаточным естественным зрением.
Регенерация клеток
Терапия стволовыми клетками потенциально может вылечить слепоту даже на поздних стадиях заболевания. Поскольку стволовые клетки можно превратить в клетки любого типа, их можно использовать для выращивания свежих клеток сетчатки для трансплантации в глаз взамен утраченных. Однако исследования на животных показали, что лишь небольшая часть пересаженных нейронов способна правильно интегрироваться в сложную нервную систему сетчатки. Это серьезное препятствие для лечения стволовыми клетками, направленного на замену нейронов сетчатки.
Сложная клеточная структура сетчатки включает слои фоторецепторов (зеленый) и кровеносных сосудов и нервов (пурпурный). Предоставлено: Louise Hughes/SPL
. Клетки, составляющие пигментный эпителий сетчатки, с другой стороны, находятся за пределами схемы сетчатки. Таким образом, терапия на основе стволовых клеток наиболее перспективна для таких состояний, как AMD и пигментный ретинит, которые вызывают дегенерацию клеток RPE. «Фоторецепторы должны подключаться к схеме, а пигментный эпителий сетчатки — нет», — говорит Роска. «Вот где люди ближе всего к успеху». Первоначально исследователи пытались вводить в сетчатку суспензионные клетки RPE, полученные из стволовых клеток, но слишком немногие застряли там, где они были необходимы. Некоторые команды теперь считают, что лучшим подходом является трансплантация клеток RPE в глаз в виде предварительно сформированного листа, который затем удерживается на месте с помощью биосовместимого каркаса. «Подход с каркасом — это огромное улучшение по сравнению с суспензией для клеток RPE», — говорит Сахель.
«Фоторецепторы должны подключаться к схеме, а пигментный эпителий сетчатки — нет», — говорит Роска. «Вот где люди ближе всего к успеху». Первоначально исследователи пытались вводить в сетчатку суспензионные клетки RPE, полученные из стволовых клеток, но слишком немногие застряли там, где они были необходимы. Некоторые команды теперь считают, что лучшим подходом является трансплантация клеток RPE в глаз в виде предварительно сформированного листа, который затем удерживается на месте с помощью биосовместимого каркаса. «Подход с каркасом — это огромное улучшение по сравнению с суспензией для клеток RPE», — говорит Сахель.
В марте 2018 года Лондонский проект по лечению слепоты — совместный проект Университетского колледжа Лондона и глазной больницы Мурфилдс в Лондоне — объявил о результатах исследования фазы I, в ходе которого лист клеток РПЭ был имплантирован в сетчатку двух человек с влажная форма ВМД (редкая, серьезная форма ВМД, связанная с аномальным ростом и просачиванием кровеносных сосудов). Оба реципиента хорошо перенесли процедуру и смогли прочитать на 21–29 букв больше в таблице чтения, чем до лечения 12 . В следующем месяце команда под руководством Хумаюна сообщила об аналогичных результатах фазы I у пяти человек с сухой AMD, более распространенной формой состояния 13 . Эти первоначальные результаты полны надежд. «Это вызвало большое волнение, — говорит Хумаюн. Но результаты должны быть подтверждены испытаниями фазы III с большим числом участников, и Хумаюн предупреждает, что лечение может быть использовано в клинике через много лет, потому что ни одна терапия стволовыми клетками для лечения заболеваний сетчатки еще не прошла через это. процесс утверждения.
Оба реципиента хорошо перенесли процедуру и смогли прочитать на 21–29 букв больше в таблице чтения, чем до лечения 12 . В следующем месяце команда под руководством Хумаюна сообщила об аналогичных результатах фазы I у пяти человек с сухой AMD, более распространенной формой состояния 13 . Эти первоначальные результаты полны надежд. «Это вызвало большое волнение, — говорит Хумаюн. Но результаты должны быть подтверждены испытаниями фазы III с большим числом участников, и Хумаюн предупреждает, что лечение может быть использовано в клинике через много лет, потому что ни одна терапия стволовыми клетками для лечения заболеваний сетчатки еще не прошла через это. процесс утверждения.
Родственный подход, все еще находящийся на ранних стадиях фундаментальных исследований, мог бы оправдать надежду на замену утраченных нейронов, открывая двери для лечения широкого спектра заболеваний глаз. У человека зрелые нейроны не делятся и поэтому не могут регенерировать, что особенно затрудняет восстановление зрения. Но то же самое верно не для всех животных. Рептилии и некоторые рыбы могут регенерировать нейроны сетчатки, а птицы также обладают некоторой регенеративной способностью. Томас Рех, нейробиолог из Вашингтонского университета в Сиэтле, пытается раскрыть эту способность у людей. Но вместо того, чтобы пересаживать клетки, выращенные в лаборатории, Рех стремится уговорить клетки, которые уже находятся в сетчатке, дифференцироваться в новые нейроны.
Но то же самое верно не для всех животных. Рептилии и некоторые рыбы могут регенерировать нейроны сетчатки, а птицы также обладают некоторой регенеративной способностью. Томас Рех, нейробиолог из Вашингтонского университета в Сиэтле, пытается раскрыть эту способность у людей. Но вместо того, чтобы пересаживать клетки, выращенные в лаборатории, Рех стремится уговорить клетки, которые уже находятся в сетчатке, дифференцироваться в новые нейроны.
В 2001 году Reh предположил, что мюллеровская глия — клетки, обеспечивающие структуру сетчатки и поддерживающие ее функции, — являются источником новых нейронов, которые наблюдались у рыб и птиц 14 . Затем он и его команда приступили к выяснению того, можно ли использовать глию Мюллера для создания свежих нейронов у мышей. В 2015 году они сконструировали мышей, чтобы они производили Ascl1, белок, важный для образования нейронов у рыб, а затем повредили сетчатку животных 15 . Они надеялись, что Ascl1 спровоцирует трансформацию мюллеровой глии в нейроны.
В эксперименте не удалось получить новые нейроны у взрослых мышей, но удалось добиться успеха у молодых мышей. Николас Йорстад, биохимик и аспирант в команде Реса, предположил, что химические модификации хроматина (комплекса ДНК, РНК и белков) в ядре клетки во время развития могут блокировать доступ зрелых клеток к генам, которые позволяют глии Мюллера трансформировать в нейроны. В августе 2017 года группа Реха показала, что, вводя фермент, который обращает такие модификации вспять, они могут уговорить мюллеровскую глию дифференцировать 9 клеток.0003 16 . «Впервые мы смогли регенерировать нейроны у взрослой мыши», — говорит Рех. «После всех этих лет я был очень взволнован». Хотя они не были настоящими фоторецепторными клетками и больше походили на биполярные клетки, нейроны были связаны с существующей схемой и были чувствительны к свету. «Я был удивлен, что они так хорошо взаимодействуют друг с другом, — говорит Рех.
Еще из Nature Outlooks
Несмотря на то, что лечение заболеваний сетчатки у людей еще не готово, работа имеет огромный потенциал. Следующим шагом будет повторение исследований на животных с глазами, более похожими на глаза человека. Команда Реха уже работает с культурами клеток сетчатки нечеловеческих приматов. Исследователям также необходимо выяснить, как направить процесс дифференцировки для производства определенных типов клеток, таких как палочки и колбочки. «Теперь, когда мы занялись производством нейронов, колбочки были бы великолепны», — говорит Рех.
Следующим шагом будет повторение исследований на животных с глазами, более похожими на глаза человека. Команда Реха уже работает с культурами клеток сетчатки нечеловеческих приматов. Исследователям также необходимо выяснить, как направить процесс дифференцировки для производства определенных типов клеток, таких как палочки и колбочки. «Теперь, когда мы занялись производством нейронов, колбочки были бы великолепны», — говорит Рех.
В случае успеха подход может быть широко применим. «В конечном счете именно так будут лечиться все эти глазные болезни», — прогнозирует Рех. «Это просто имеет смысл. Вам не нужно беспокоиться о правильной пересадке. Ваши клетки именно там, где они вам нужны».
Хумаюн также воодушевлен работой. «Я поддерживаю любого, у кого есть новая хорошая идея», — говорит он. «Еще очень рано, это высокий риск, но никогда не говори никогда. Вот чему я научился».
Лечение слепоты и потери зрения
Испанский | Если бы вы видели, как прошлым летом Лиза Кулик и ее муж прогуливались по территории Института глазных болезней Университета Южной Калифорнии, вы бы ничего об этом не подумали. Но для Кулика эта простая прогулка по кампусу была «чудом». Ослепшая более двух десятилетий из-за наследственного заболевания глаз, называемого пигментным ретинитом, Кулик снова стала видеть — достаточно ясно, чтобы разглядеть тротуар и травянистую опушку — благодаря сложному микрочипу, имплантированному ей в один глаз.
Но для Кулика эта простая прогулка по кампусу была «чудом». Ослепшая более двух десятилетий из-за наследственного заболевания глаз, называемого пигментным ретинитом, Кулик снова стала видеть — достаточно ясно, чтобы разглядеть тротуар и травянистую опушку — благодаря сложному микрочипу, имплантированному ей в один глаз.
Устройство, названное Argus II, является лишь одним из растущего числа новых смелых подходов к лечению слепоты, дающим надежду миллионам американцев, в основном пожилых людей, которым грозит потеря зрения из-за дегенерации желтого пятна, глаукомы, диабетической ретинопатии и других заболеваний. заболевания глаз. На самом деле прогресс в офтальмологии настолько стремителен, что некоторые исследователи уже начали предполагать конец многим формам потери зрения. «Нам еще многому предстоит научиться», — признает Стивен Роуз, главный научный сотрудник Фонда борьбы со слепотой. «Но вопрос не в том, покончим ли мы со слепотой. На самом деле вопрос только в том, когда».
Эдвард Линсмьер
Джо Веллоне, 76 лет, получил имплантат телескопа, чтобы улучшить свое зрение.
Телескоп для наблюдения за звездамиВ течение многих лет 76-летний Джо Веллоне наблюдал постепенное ухудшение зрения из-за возрастной дегенерации желтого пятна (AMD), состояния, при котором светочувствительные клетки макулы — центральной части сетчатки — уничтожаются. «У меня было настолько плохое зрение, что я проходил мимо знакомых, потому что не видел их. Я вообще не мог читать», — говорит Веллоне, который живет в Сомерсе, штат Нью-Йорк, со своей женой.
В прошлом году хирурги вставили ему в один глаз телескопический имплантат производства VisionCare. Подобно телескопу для наблюдения за звездами, крошечное устройство увеличивает небольшую область и проецирует изображение на всю сетчатку, позволяя здоровым клеткам разглядеть его. «Это изменило мою жизнь, — говорит Веллоне. «Я снова читаю. Я могу смотреть футбольные матчи по телевизору. Прошлым летом я мог видеть достаточно хорошо, чтобы снова посадить огород — баклажаны, помидоры, перец».
Прошлым летом я мог видеть достаточно хорошо, чтобы снова посадить огород — баклажаны, помидоры, перец».
Телескопический имплантат VisionCare недавно получил одобрение FDA для пациентов 65 лет и старше с терминальной стадией AMD. Телескоп имплантируется только в один глаз, так что другой глаз продолжает иметь полное периферийное зрение. Имплантат нельзя устанавливать в глаз, в котором была проведена операция по удалению катаракты. А поскольку у некоторых людей возникают проблемы с адаптацией к разным изображениям, получаемым каждым глазом, офтальмологи проводят с потенциальными кандидатами серию тестов, чтобы определить, подходят ли они. «К счастью, мозг обычно способен приспосабливаться к двум разным изображениям», — объясняет офтальмолог Дэвид Бойер, руководитель медицинской группы Retina-Vitreous Associates в Южной Калифорнии. «У многих пациентов мы видим значительные улучшения».
Bryan Christie
Инъекционные препараты против VEGF могут помочь обратить вспять повреждение глаз и стабилизировать зрение.
Влажная дегенерация желтого пятна возникает, когда аномальные кровеносные сосуды разрастаются под сетчаткой, часто происходит утечка жидкости или крови в макулу и повреждение центрального зрения. Хотя влажная форма ВМД встречается гораздо реже, чем сухая форма, при которой отложения разрушают макулу, она гораздо более разрушительна и приводит к более быстрой и глубокой потере зрения. К счастью, новый класс препаратов, называемых анти-VEGF агентами, теперь широко доступен, может остановить, а иногда даже обратить вспять повреждение. Введенные в глаз лекарства блокируют белки VEGF, которые обычно помогают формированию кровеносных сосудов. «До появления препаратов против VEGF у нас не было ничего, чтобы остановить влажную дегенерацию желтого пятна», — говорит Джеффри Хейер, доктор медицинских наук, председатель отдела исследований и терапии Американского общества специалистов по сетчатке и директор витреоретинальной службы Ophthalmic Consultants of Boston. «Теперь у большинства пациентов мы можем стабилизировать зрение, а у некоторых даже частично восстановить зрение».
«Теперь у большинства пациентов мы можем стабилизировать зрение, а у некоторых даже частично восстановить зрение».
У прививок есть один большой недостаток: их нужно делать не реже одного раза в месяц. Чтобы исключить повторные инъекции, исследователи разрабатывают инновационные способы доставки лекарств в глаза. По словам Хейера, один из исследуемых подходов заключается в имплантации небольшого резервуара, который постепенно высвобождает лекарство. Другая, более драматичная возможность: использование генной терапии для перепрограммирования клеток глаза на производство собственных агентов против VEGF.
Святым Граалем исследований по лечению дегенерации желтого пятна является поиск способов регенерации здоровых клеток для замены поврежденных болезнью. Это может быть не за горами. В 2014 году команда Глазного института Жюля Стейна при Калифорнийском университете в Лос-Анджелесе сообщила о раннем успешном выращивании клеток сетчатки в лаборатории и введении их в глаза пациентам с несколькими различными формами ВМД. Ученые начали с плюрипотентных стволовых клеток, которые способны стать любой клеткой. «В течение нескольких месяцев клетки превращаются в клетки пигментного эпителия сетчатки, которые поддерживают фоторецепторные клетки в сетчатке», — объясняет Эдди Англад, доктор медицинских наук, главный медицинский директор Ocata Therapeutics, компании из Массачусетса, которая разрабатывает процедура. Первые результаты показывают значительное улучшение зрения у некоторых пациентов, и в настоящее время проводятся клинические испытания для усовершенствования процедуры.
Ученые начали с плюрипотентных стволовых клеток, которые способны стать любой клеткой. «В течение нескольких месяцев клетки превращаются в клетки пигментного эпителия сетчатки, которые поддерживают фоторецепторные клетки в сетчатке», — объясняет Эдди Англад, доктор медицинских наук, главный медицинский директор Ocata Therapeutics, компании из Массачусетса, которая разрабатывает процедура. Первые результаты показывают значительное улучшение зрения у некоторых пациентов, и в настоящее время проводятся клинические испытания для усовершенствования процедуры.
«Бионический глаз», который частично восстановил зрение Лизы Кулик, использует крошечную видеокамеру, установленную на очках, для передачи световых сигналов на микрочип, имплантированный в глаз. Затем микрочип передает эту информацию в мозг, хотя он собирает лишь малую часть информации, которую получает здоровый глаз. «Но этого достаточно, чтобы слепые люди могли видеть большие объекты и различать их контуры», — говорит офтальмолог и биомедицинский инженер из Университета Южной Калифорнии Марк Хумаюн, который участвовал в разработке Argus II.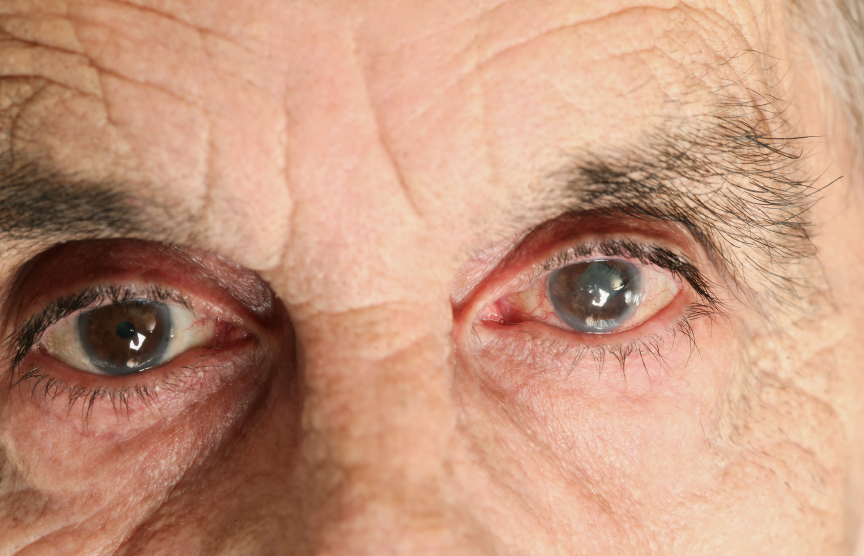 На данный момент устройство одобрено FDA для лечения пигментного ретинита, наследственного заболевания, которым страдают около 100 000 американцев, хотя в будущем оно может иметь более широкое применение.
На данный момент устройство одобрено FDA для лечения пигментного ретинита, наследственного заболевания, которым страдают около 100 000 американцев, хотя в будущем оно может иметь более широкое применение.
Используя другой подход, исследователи из калифорнийской компании Eos Neuroscience успешно внедрили под сетчатку ген, который позволяет клеткам улавливать свет. Цель состоит в том, чтобы сконструировать здоровые клетки глаза, чтобы заменить клетки фоторецепторов, которые были разрушены пигментным ретинитом или дегенерацией желтого пятна. Эксперименты на мышах показали, что встроенный ген позволяет слепым мышам ориентироваться при помощи света. Испытания на людях могут начаться в ближайшее время.
Bryan Christie
Контактная линза с лекарством от глаукомы является альтернативой глазным каплям.
Глаукома В течение многих лет единственным средством лечения глаукомы, возникающей в результате повышения внутриглазного давления и являющейся основной причиной слепоты среди людей старше 60 лет, были лекарственные глазные капли. Но заставить людей использовать капли каждый день до конца жизни оказалось крайне сложно. Опросы показывают, что до половины людей с глаукомой перестали использовать глазные капли после первого года. «Люди забывают. У них проблемы с закапыванием глазных капель», — объясняет Джозеф Чиолино, офтальмолог из Массачусетского института глаз и ушей Гарвардской медицинской школы. «А поскольку капли замедляют прогрессирование глаукомы, но не улучшают зрение, людей трудно мотивировать продолжать принимать лекарства».
Но заставить людей использовать капли каждый день до конца жизни оказалось крайне сложно. Опросы показывают, что до половины людей с глаукомой перестали использовать глазные капли после первого года. «Люди забывают. У них проблемы с закапыванием глазных капель», — объясняет Джозеф Чиолино, офтальмолог из Массачусетского института глаз и ушей Гарвардской медицинской школы. «А поскольку капли замедляют прогрессирование глаукомы, но не улучшают зрение, людей трудно мотивировать продолжать принимать лекарства».
В качестве альтернативы каплям Чолино и его коллега Дэниел Кохейн, доктор медицины, который руководит Лабораторией биоматериалов и доставки лекарств в Бостонской детской больнице, разработали контактную линзу, которая содержит лекарство от глаукомы, заключенное в тонкую полимерную пленку. Исследования, проведенные в прошлом году, показали, что линза высвобождает постоянную и постоянную дозу лекарства в течение месяца. Линзы для доставки лекарств также могут быть пропитаны антибиотиками или противовоспалительными препаратами для лечения инфекций и других заболеваний глаз. И в качестве дополнительного преимущества линзы могут быть разработаны для коррекции проблем со зрением, таких как близорукость или дальнозоркость, что послужит дополнительной мотивацией для людей с глаукомой использовать их.
И в качестве дополнительного преимущества линзы могут быть разработаны для коррекции проблем со зрением, таких как близорукость или дальнозоркость, что послужит дополнительной мотивацией для людей с глаукомой использовать их.
Другие инновационные подходы находятся в стадии изучения. Исследователи разрабатывают имплантируемые устройства, которые могут измерять внутриглазное давление и вводить точные дозы лекарств, чтобы контролировать его, например, когда оно поднимается слишком высоко. А продолжающиеся исследования со стволовыми клетками и генной терапией могут предоставить инструменты для регенерации здоровых клеток зрительного нерва, устраняя повреждения, вызванные глаукомой.
Не подозревая о рисках С ростом заболеваемости диабетом офтальмологи начали отслеживать резкое увеличение одного из его последствий — лишающего зрения заболевания, называемого диабетической ретинопатией. По всей стране диабетическая ретинопатия в настоящее время является ведущей причиной слепоты среди взрослых в возрасте от 20 до 74 лет, затрагивая более 4 миллионов американцев. Повышенный уровень сахара в крови, связанный с диабетом, постепенно повреждает клетки сетчатки, ухудшая зрение. Только в последние год или два врачи начали использовать анти-VEGF-препараты, одобренные для влажной формы AMD, для защиты от диабетической ретинопатии.
Повышенный уровень сахара в крови, связанный с диабетом, постепенно повреждает клетки сетчатки, ухудшая зрение. Только в последние год или два врачи начали использовать анти-VEGF-препараты, одобренные для влажной формы AMD, для защиты от диабетической ретинопатии.
Но новейшие препараты для спасения зрения эффективны только в том случае, если люди знают, что у них прогрессирующие заболевания глаз. Многие этого не делают. Когда исследователь офтальмологии из Университета Южной Калифорнии Рохит Варма, доктор медицинских наук, несколько лет назад изучал испаноязычных жителей Лос-Анджелеса, он обнаружил, что у четверти из них был диабет 2 типа, а у половины из них были признаки заболевания глаз, но большинство из них совершенно не знали об этом. опасность. «Мы добились колоссального прогресса, — говорит Варма, руководитель Глазного института Университета Южной Калифорнии.
«Самое большое препятствие, с которым мы сталкиваемся в предотвращении потери зрения и слепоты, — это заставить людей обратиться к офтальмологу», — добавляет Варма.


