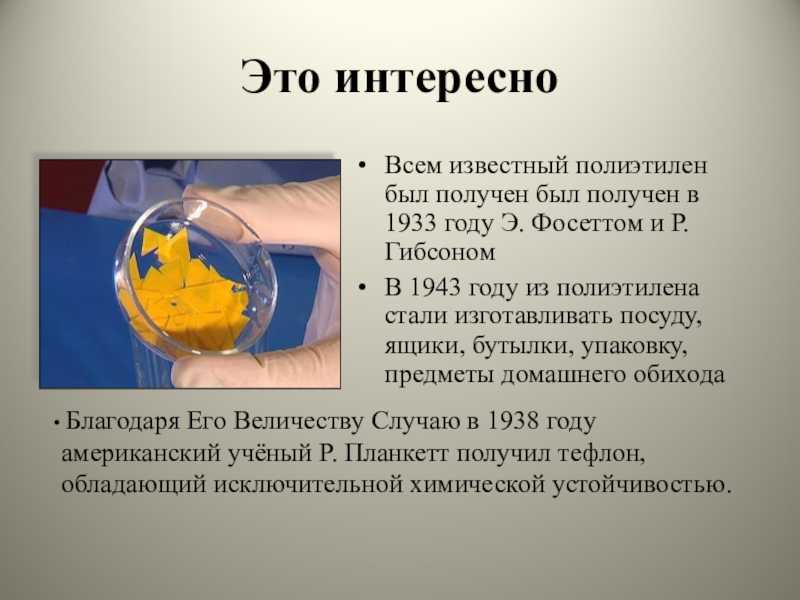
Химия. Интересные факты
Химия — одна из древнейших наук. Она изучает вещества, их соединения, строение, превращения. Первые сведения о химических превращениях люди получили, занимаясь различными ремеслами. Значительный вклад в становление химии внесли алхимики. В поисках философского камня, способного превратить любой металл в золото, они совершили немало научных открытий. История развития химии полна интересных событий и удивительных экспериментов.
Основные правила поведения в химической лаборатории
- Если вы что-то откупорили, немедленно закупорьте.
- Если включили, выключите.
- Если открыли, закройте.
- Если у вас в руках жидкое — не разлейте, порошкообразное — не рассыпьте, газообразное — не выпустите наружу.
- Если вы не знаете, как это действует, — не трогайте.
Дороже золота
В 1669 году немецкий алхимик Хенниг Бранд в поисках философского камня решил попробовать синтезировать золото из человеческой мочи. В процессе своих экспериментов с мочой он получил белый порошок, светящийся в темноте. Хенниг принял его за «первичную материю» золота и назвал «светоносец» (что по-гречески произносится как «фосфор»). Когда дальнейшие опыты с этим порошком так и не привели к получению драгоценного металла, алхимик начал продавать новое вещество еще дороже, чем само золото.
В процессе своих экспериментов с мочой он получил белый порошок, светящийся в темноте. Хенниг принял его за «первичную материю» золота и назвал «светоносец» (что по-гречески произносится как «фосфор»). Когда дальнейшие опыты с этим порошком так и не привели к получению драгоценного металла, алхимик начал продавать новое вещество еще дороже, чем само золото.
Великий химик
В один из дней 1837 года в подвале частного пансиона в Казани раздался оглушительный взрыв. Виновником его оказался 9-летний воспитанник Саша Бутлеров, который пытался изготовить то ли порох, то ли «бенгальские огни». Воспитатель сурово наказал ученика.
Три дня подряд Саша ходил с повешенной на груди табличкой, на которой крупными буквами было написано: «ВЕЛИКИЙ ХИМИК». Впоследствии эти слова стали пророческими — нарушитель дисциплины стал великим русским химиком Александром Михайловичем Бутлеровым, создателем теории химического строения органических веществ, ректором Императорского Казанского университета.
Кто изобрел небьющееся стекло?
В 1903 году французский химик Эдуард Бенедиктус случайно уронил колбу, заполненную нитроцеллюлозой. Стенки колбы покрылись сеткой трещин, но сама она не разбилась. Удивившись такому факту, ученый провел несколько опытов — он делал «сандвичи» из двух стекол и слоя нитрата целлюлозы между ними. При нагревании слой целлюлозы расплавлялся и склеивал стекла между собой. Такой «сандвич» можно было бить молотком — он трескался, но сохранял форму и не давал осколков. В 1909 году Бенедиктус получил патент на безопасное стекло, которое назвал «триплекс».
Примечательно, что первыми на новый материал обратили внимание военные — во время Первой мировой войны из него делали стекла противогазов. И только в 1919 году Генри Форд начал использовать триплекс в производстве лобовых стекол автомобилей.
Царская водка
Царская водка — это смесь концентрированных кислот, очень опасное ядовитое вещество. Имеет желтоватый цвет и запах хлора. В ее состав входят соляная кислота НС1 (один объем) и азотная HNO3 (три объема). Иногда к ним добавляется серная кислота (H2SO4). Своим названием «Царская водка» обязана уникальному свойству — она растворяет почти все металлы, включая золото и платину, но при этом не растворяет ни керамику, ни стекло.
В ее состав входят соляная кислота НС1 (один объем) и азотная HNO3 (три объема). Иногда к ним добавляется серная кислота (H2SO4). Своим названием «Царская водка» обязана уникальному свойству — она растворяет почти все металлы, включая золото и платину, но при этом не растворяет ни керамику, ни стекло.
Когда во время Второй мировой войны немецкие войска оккупировали датскую столицу Копенгаген, венгерский химик Дьердь де Хевеши растворил в царской водке золотые нобелевские медали немецких физиков Макса фон Лауз и Джеймса Франка, не имея другой возможности спрятать их от немецких оккупантов. После войны Хевеши выделил спрятанное в царской водке золото и передал его Шведской королевской академии наук, которая изготовила новые медали и передала их фон Лауз и Франку.
Поделиться ссылкой
Это интересно…
история Тюльпаномания в Голландии
интересные факты Самые громкие ограбления
животные Какие бывают рыбы?
история Болезнь ведьм
интересные факты Самые абсурдные судебные иски
животные Самая кровожадная рыба-людоед
психология Как мы думаем?
интересные факты Самые смешные штрафы
история открытия, интересные факты и байки – Москва 24, 24.
 10.2012
10.201224 октября 2012, 17:45
Наука
Фото: ИТАР-ТАСС
Открытие таблицы периодических химических элементов стало одной из важных вех в истории развития химии как науки. Первооткрывателем таблицы стал российский ученый Дмитрий Менделеев. Неординарный ученый с широчайшим научным кругозором сумел объединить все представления о природе химических элементов в единую стройную концепцию.
Об истории открытия таблицы периодических элементов, интересных фактах, связанных с открытием новых элементов, и народных байках, которые окружали Менделеева и созданную им таблицу химических элементов, М24.RU расскажет в этой статье.
История открытия таблицы
К середине XIX века было открыто 63 химических элемента, и ученые всего мира не раз предпринимали попытки объединить все существовавшие элементы в единую концепцию. Элементы предлагали разместить в порядке возрастания атомной массы и разбить на группы по сходству химических свойств.
В 1863 году свою теорию предложил химик и музыкант Джон Александр Ньюленд, который предложил схему размещения химических элементов, схожую с той, что открыл Менделеев, но работа ученого не была принята всерьез научным сообществом из-за того, что автор увлекся поисками гармонии и связью музыки с химией.
В 1869 году Менделеев опубликовал свою схему периодической таблицы в журнале Русского химического общества и разослал извещение об открытии ведущим ученым мира. В дальнейшем химик не раз дорабатывал и улучшал схему, пока она не приобрела привычный вид.
Суть открытия Менделеева в том, что с ростом атомной массы химические свойства элементов меняются не монотонно, а периодически. После определенного количества разных по свойствам элементов, свойства начинают повторяться. Так, калий похож на натрий, фтор — на хлор, а золото схоже с серебром и медью.
В 1871 году Менделеев окончательно объединил идеи в периодический закон. Ученые предсказал открытие нескольких новых химических элементов и описал их химические свойства. В дальнейшем расчеты химика полностью подтвердились — галлий, скандий и германий полностью соответствовали тем свойствам, которые им приписал Менделеев.
Байки о Менделееве
Гравюра, на которой изображен Менделеев. Фото: ИТАР-ТАСС
Об известном ученом и его открытиях ходило немало баек. Люди в то время слабо представляли себе химию и считали, что занятия химией — это что-то вроде поедания супа из младенцев и воровства в промышленных масштабах. Поэтому деятельность Менделеева быстро обросла массой слухов и легенд.
Люди в то время слабо представляли себе химию и считали, что занятия химией — это что-то вроде поедания супа из младенцев и воровства в промышленных масштабах. Поэтому деятельность Менделеева быстро обросла массой слухов и легенд.
Одна из легенд гласит, что Менделеев открыл таблицу химических элементов во сне. Случай не единственный, точно также говорил о своем открытии Август Кекуле, которому приснилась формула бензольного кольца. Однако Менделеев только смеялся над критиками. «Я над ней, может быть, двадцать лет думал, а вы говорите: сидел и вдруг … готово!», — как-то сказал ученый о своем открытии.
Другая байка приписывает Менделееву открытие водки. В 1865 году великий ученый защитил диссертацию на тему «Рассуждение о соединении спирта с водою», и это сразу дало повод для новой легенды. Современники химика посмеивались, мол ученый «неплохо творит под действием спирта, соединенного с водой», а следующие поколения уже называли Менделеева первооткрывателем водки.
Посмеивались и над образом жизни ученого, а особенно над тем, что Менделеев оборудовал свою лабораторию в дупле огромного дуба.
Также современники подтрунивали над страстью Менделеева к чемоданам. Ученый в пору своего невольного бездействия в Симферополе вынужден был коротать время за плетением чемоданов. В дальнейшем он самостоятельно мастерил для нужд лаборатории картонные контейнеры. Несмотря на явно «любительский» характер этого увлечения, Менделеева часто называли «чемоданных дел мастером».
Открытие радия
Одна из наиболее трагичных и в то же время известных страниц в истории химии и появления новых элементов в таблице Менделеева связана с открытием радия. Новый химический элемент был открыт супругами Марией и Пьером Кюри, которые обнаружили, что отходы, остающиеся после выделения урана из урановой руды, более радиоактивны, чем чистый уран.
Поскольку о том, что такое радиоактивность, тогда еще никто не знал, то новому элементу молва быстро приписала целебные свойства и способность излечивать чуть ли не от всех известных науке болезней. Радий включили в состав пищевых продуктов, зубной пасты, кремов для лица. Богачи носили часы, циферблат которых был окрашен краской, содержащей радий. Радиоактивный элемент рекомендовали как средство для улучшения потенции и снятия стресса.
Богачи носили часы, циферблат которых был окрашен краской, содержащей радий. Радиоактивный элемент рекомендовали как средство для улучшения потенции и снятия стресса.
Подобное «производство» продолжалось целых двадцать лет — до 30-х годов двадцатого века, когда ученые открыли истинные свойства радиоактивности и выяснили насколько губительно влияние радиации на человеческий организм.
Мария Кюри умерла в 1934 году от лучевой болезни, вызванной долговременным воздействием радия на организм.
Небулий и короний
Фото: ИТАР-ТАСС
Таблица Менделеева не только упорядочила химические элементы в единую стройную систему, но и позволила предсказать многие открытия новых элементов. В то же время некоторые химические «элементы» были признаны несуществующими на основании того, что они не укладывались в концепцию периодического закона. Наиболее известна история с «открытием» новых элементов небулия и корония.
При исследовании солнечной атмосферы астрономы обнаружили спектральные линии, которые им не удалось отождествить ни с одним из известных на земле химических элементов. Ученые предположили, что эти линии принадлежат новому элементу, который получил название короний (потому что линии были обнаружены при исследовании «короны» Солнца — внешнего слоя атмосферы звезды).
Ученые предположили, что эти линии принадлежат новому элементу, который получил название короний (потому что линии были обнаружены при исследовании «короны» Солнца — внешнего слоя атмосферы звезды).
Спустя несколько лет астрономы сделали еще одно открытие, изучая спектры газовых туманностей. Обнаруженные линии, которые снова не удалось отождествить ни с чем земным, приписали другому химическому элементу — небулию.
Открытия подверглись критике, поскольку в периодической таблице Менделеева уже не оставалось места для элементов, обладающих свойствами небулия и корония. После проверки обнаружилось, что небулий является обычным земным кислородом, а короний — сильно ионизированное железо.
Отметим, что сегодня в московском Центральном доме ученых РАН торжественно присвоят имена двум химическим элементам, открытым учеными из подмосковной Дубны.
Материал создан на основе информации из открытых источников. Подготовил Василий Макагонов @vmakagonov
наука химия таблица Менделеева обо всем
1.
 2: История химии — Chemistry LibreTexts
2: История химии — Chemistry LibreTexts- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 52256
Откуда взялась химия? Ранние «химики» сосредоточились на практических проблемах — как сделать красители и духи, производство мыла, использование металлов и производство стекла, среди прочего. Цель состояла не в том, чтобы понять физический мир — это пришло позже. Люди просто хотели делать вещи, которые каким-то образом улучшали их жизнь.
История химии
История химии интересная и сложная. Очень ранние химики часто были мотивированы главным образом достижением конкретной цели или продукта. Для изготовления духов и мыла не требовалось много теории , просто хороший рецепт и тщательное внимание к деталям. Не было стандартного способа именования материалов (и таблицы Менделеева, с которой все могли бы согласиться). Однако наука развивалась веками.
Не было стандартного способа именования материалов (и таблицы Менделеева, с которой все могли бы согласиться). Однако наука развивалась веками.
Значительный прогресс был достигнут в том, чтобы поставить химию на прочный фундамент, когда Роберт Бойль (1637-1691) начал свои исследования в области химии. Он развил основные представления о поведении газов; впоследствии газы можно было описать математически. Бойль также помог выдвинуть идею о том, что маленькие частицы могут объединяться в молекулы. Много лет спустя Джон Дальтон использовал эти идеи для развития атомной теории.
Рисунок \(\PageIndex{1}\): Роберт Бойл. (Источник: Йоханн Керсебум; Источник: http://commons.wikimedia.org/wiki/File:Robert_Boyle_0001.jpg(открывается в новом окне); Лицензия: Public Domain) Область химии начала быстро развиваться в 1700-х годах. Джозеф Пристли (1733-1804) выделил и охарактеризовал несколько газов: кислород, монооксид углерода и закись азота. Позже было обнаружено, что закись азота («веселящий газ») действует как анестетик. Этот газ впервые был использован для этой цели в 1844 году при удалении зуба. Другими газами, открытыми в то время, были хлор, К. В. Шееле (1742–1786) и азот, Антуан Лавуазье (1743–1794). Многие ученые считают Лавуазье «отцом химии».
Этот газ впервые был использован для этой цели в 1844 году при удалении зуба. Другими газами, открытыми в то время, были хлор, К. В. Шееле (1742–1786) и азот, Антуан Лавуазье (1743–1794). Многие ученые считают Лавуазье «отцом химии».
Химики продолжали открывать новые соединения в 1800-х годах. Наука также начала развивать более теоретическую основу. Джон Дальтон (1766-1844) выдвинул свою атомную теорию в 1807 году. Эта идея позволила ученым гораздо более систематически рассматривать химию. Амадео Авогадро (1776–1856) заложил основу для более количественного подхода к химии, подсчитав количество частиц в заданном количестве газа. Много сил было приложено к изучению химических реакций. Эти усилия привели к созданию новых материалов. После изобретения батареи Алессандро Вольта (1745-1827) область электрохимии (как теория, так и приложения) развивалась благодаря большому вкладу Гемфри Дэви (1778-1829).) и Майкл Фарадей (1791-1867). Другие области дисциплины также быстро развивались.
Потребовалась бы большая книга, чтобы охватить достижения в области химии в двадцатом веке и до наших дней. Одной из основных областей расширения была область химии живых процессов. Исследования фотосинтеза в растениях, открытие и характеристика ферментов как биохимических катализаторов, выяснение структуры биомолекул, таких как инсулин и ДНК, — эти усилия привели к взрыву информации в области биохимии.
Практические аспекты химии не остались без внимания. Работа Вольты, Дэви и Фарадея в конечном итоге привела к разработке батарей, которые стали источником электричества для питания ряда устройств.
Рисунок \(\PageIndex{2}\): Аккумулятор, разработанный Volta. (Источник: Адольф Ганот; Источник: http://commons.wikimedia.org/wiki/File:Voltaic_pile_battery.png(opens in new window)) Чарльз Гудиер (1800-1860) открыл процесс вулканизации, позволивший получить стабильную резину продукт, который будет производиться для шин всех транспортных средств, которые у нас есть сегодня. Луи Пастер (1822-189 гг.)5) впервые применил термическую стерилизацию для уничтожения нежелательных микроорганизмов в вине и молоке. Альфред Нобель (1833-1896) изобрел динамит. После его смерти состояние, которое он заработал на этом продукте, было использовано для финансирования Нобелевских премий в области естественных и гуманитарных наук. Дж. В. Хаятт (1837-1920) разработал первый пластик. Лео Бэкеланд (1863-1944) разработал первую синтетическую смолу, которая широко используется для изготовления недорогой и прочной столовой посуды.
Луи Пастер (1822-189 гг.)5) впервые применил термическую стерилизацию для уничтожения нежелательных микроорганизмов в вине и молоке. Альфред Нобель (1833-1896) изобрел динамит. После его смерти состояние, которое он заработал на этом продукте, было использовано для финансирования Нобелевских премий в области естественных и гуманитарных наук. Дж. В. Хаятт (1837-1920) разработал первый пластик. Лео Бэкеланд (1863-1944) разработал первую синтетическую смолу, которая широко используется для изготовления недорогой и прочной столовой посуды.
Резюме
- рост хим.
- Многие ранние химические исследования были сосредоточены на практическом использовании.

- Основные химические теории были разработаны в девятнадцатом веке.
- Новые материалы и аккумуляторы – продукты современной химии.
Обзор
- Кто изобрел первую батарею?
- Какой вклад в химию внес Роберт Бойль?
- Кто изобрел динамит?
- Для чего была использована первая синтетическая смола?
Подробнее
Используйте этот ресурс, чтобы ответить на следующие вопросы: http://www.columbia.edu/itc/chemistr…/chemhist.html
- Кто опубликовал теорию атома?
- Какие элементы предлагает Аристотель?
- Кто открыл протон?
- Какие новые элементы открыла Мария Кюри?
- Кого называют «отцом современной химии»?
Эта страница под названием 1.2: History of Chemistry распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 через исходный контент, отредактированный в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Автор
- Фонд CK-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.
- Теги
- источник@https://flexbooks.
 ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
- источник@https://flexbooks.
История химии | Известные химики
Когда вы покупаете по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Вот как это работает.
Пьер и Мария Кюри в своей лаборатории до 1907 года. (Изображение предоставлено: общественное достояние)Во многом история цивилизации — это история химии — изучения материи и ее свойств. Люди всегда стремились идентифицировать, использовать и изменять материалы в окружающей нас среде. Ранние гончары использовали красивую глазурь для украшения и сохранения своих изделий. Пастухи, пивовары и виноделы использовали методы ферментации для производства сыра, пива и вина. Хозяйки выщелачивали щелочь из древесной золы, чтобы делать мыло. Кузнецы научились соединять медь и олово для получения бронзы. Ремесленники научились делать стекло; кожевники дублили шкуры.
В восьмом веке нашей эры, Джабир ибн Хайян , мусульманский астроном, философ и ученый, стал одним из первых, кто использовал научные методы для изучения материалов. Также известный под своим латинизированным именем Гебер, он известен как «отец химии». Считается, что он является автором 22 свитков, описывающих методы дистилляции, кристаллизации, сублимации и выпаривания. Он изобрел перегонный куб, устройство, используемое для дистилляции и изучения кислот. Он также разработал раннюю систему химической классификации, используя свойства изучаемых им материалов. Его категории были:
Также известный под своим латинизированным именем Гебер, он известен как «отец химии». Считается, что он является автором 22 свитков, описывающих методы дистилляции, кристаллизации, сублимации и выпаривания. Он изобрел перегонный куб, устройство, используемое для дистилляции и изучения кислот. Он также разработал раннюю систему химической классификации, используя свойства изучаемых им материалов. Его категории были:
- «Духи» — материалы, которые испаряются при нагревании.
- «Металлы» — включая железо, олово, медь и свинец.
- Непластичные вещества — материалы, из которых можно сделать порошки, например камень.
Сегодня подобные материалы можно назвать «летучими химическими веществами, металлами и неметаллами».
Классическая химия
В Европе изучение химии проводилось алхимиками с целью превращения обычных металлов в золото или серебро и изобретения химического эликсира, продлевающего жизнь. Хотя эти цели так и не были достигнуты, в этой попытке было сделано несколько важных открытий.
Роберт Бойль (1627-1691) изучал поведение газов и обнаружил обратную зависимость между объемом и давлением газа. Он также заявил, что «всю реальность и изменения можно описать в терминах элементарных частиц и их движения», что является ранним пониманием атомной теории. В 1661 году он написал первый учебник по химии «Скептический химист», который перевел изучение веществ от мистических ассоциаций с алхимией к научным исследованиям.
К 1700-м годам Эпоха Просвещения пустила корни по всей Европе. Джозеф Пристли (1733-1804) опроверг идею о неделимости воздуха. Вместо этого он показал, что это была комбинация газов, когда выделил кислород и открыл семь других отдельных газов. Жак Шарль продолжил работу Бойля и известен тем, что установил прямую зависимость между температурой и давлением газов. В 1794 году Джозеф Пруст изучал чистые химические соединения и сформулировал закон определенных пропорций — химическое соединение всегда будет иметь свое характерное соотношение элементов. Вода, например, всегда имеет отношение водорода к кислороду два к одному.
Вода, например, всегда имеет отношение водорода к кислороду два к одному.
Антуан Лавуазье (1743-1794) был французским химиком, внесшим важный вклад в науку. Работая сборщиком налогов, Лавуазье помог разработать метрическую систему, чтобы обеспечить единообразие мер и весов. Он был принят во Французскую академию наук в 1768 году. Два года спустя, в возрасте 28 лет, он женился на 13-летней дочери своего коллеги. Мари-Анн Лавуазье , как известно, помогала своему мужу в его научных исследованиях, переводя английские статьи и делая многочисленные рисунки для иллюстрации его экспериментов.
Настойчивость Лавуазье в отношении точных измерений привела к открытию им закона сохранения массы. В 1787 году Лавуазье опубликовал «Методы химической номенклатуры», которые включали правила именования химических соединений, которые используются до сих пор. Его «Элементарный трактат по химии» (1789 г.) был первым современным учебником по химии. Он четко определил химический элемент как вещество, вес которого нельзя уменьшить в результате химической реакции, и перечислил кислород, железо, углерод, серу и почти 30 других элементов, о существовании которых тогда было известно. Однако в книге было несколько ошибок; он перечислил свет и тепло как элементы.
Его «Элементарный трактат по химии» (1789 г.) был первым современным учебником по химии. Он четко определил химический элемент как вещество, вес которого нельзя уменьшить в результате химической реакции, и перечислил кислород, железо, углерод, серу и почти 30 других элементов, о существовании которых тогда было известно. Однако в книге было несколько ошибок; он перечислил свет и тепло как элементы.
Амедео Авогадро (1776-1856) был итальянским юристом, который начал изучать естественные науки и математику в 1800 году. Развивая работу Бойля и Чарльза, он разъяснил разницу между атомами и молекулами. Далее он заявил, что равные объемы газа при одинаковых температуре и давлении имеют одинаковое количество молекул. Число молекул в образце с молекулярной массой 1 грамм (1 моль) чистого вещества названо в его честь константой Авогадро. Экспериментально установлено, что оно равно 6,023 x 10 23 молекул и является важным коэффициентом пересчета, используемым для определения массы реагентов и продуктов в химических реакциях.
В 1803 году английский метеоролог начал размышлять над явлением водяного пара. Джон Дальтон (1766-1844) знал, что водяной пар является частью атмосферы, но эксперименты показали, что водяной пар не образуется в некоторых других газах. Он предположил, что это как-то связано с количеством частиц, присутствующих в этих газах. Возможно, в этих газах не было места для проникновения частиц водяного пара. В «более тяжелых» газах было либо больше частиц, либо эти частицы были крупнее. Используя свои собственные данные и закон определенных пропорций, он определил относительные массы частиц шести известных элементов: водорода (самого легкого, которому присвоили массу 1), кислорода, азота, углерода, серы и фосфора. Дальтон объяснил свои выводы, изложив принципы первой атомной теории материи.
- Элементы состоят из очень маленьких частиц, называемых атомами.
- Атомы одного и того же элемента идентичны по размеру, массе и другим свойствам. Атомы разных элементов обладают разными свойствами.

- Атомы не могут быть созданы, разделены или уничтожены.
- Атомы различных элементов соединяются в простых соотношениях целых чисел, образуя химические соединения.
- В химических реакциях атомы объединяются, разделяются или перестраиваются с образованием новых соединений.
Дмитрий Менделеев (1834-1907) был русским химиком, известным созданием первой Периодической таблицы элементов. Он перечислил 63 известных элемента и их свойства на карточках. Расположив элементы в порядке возрастания атомной массы, он смог сгруппировать элементы со схожими свойствами. Подобными свойствами, за небольшим исключением, обладал каждый седьмой элемент (восьмая химическая группа — благородные газы — еще не была открыта). Менделеев понял, что если он оставил пробелы для тех мест, где ни один из известных элементов не вписывается в шаблон, он будет еще более точным. Используя пробелы в своей таблице, он смог предсказать свойства элементов, которые еще предстояло открыть. Первоначальная таблица Менделеева была обновлена, чтобы включить 92 природных элемента и 26 синтетических элементов.
Первоначальная таблица Менделеева была обновлена, чтобы включить 92 природных элемента и 26 синтетических элементов.
Описание атома
В 1896 году Анри Беккерель открыл излучение. Вместе с Пьером и Марией Кюри он показал, что определенные элементы излучают энергию с фиксированной скоростью. В 1903 году Беккерель разделил Нобелевскую премию с Кюри за открытие радиоактивности. В 1900 г. Макс Планк обнаружил, что энергия должна излучаться дискретными единицами, которые он назвал «квантами» (названными фотонами), а не непрерывными волнами. Оказалось, что атомы состоят из еще более мелких частиц, некоторые из которых могут разлетаться.
В 1911 году Эрнст Резерфорд продемонстрировал, что атомы состоят из крошечной плотной положительно заряженной области, окруженной относительно большими областями пустого пространства, в котором движутся еще более мелкие отрицательно заряженные частицы (электроны). Резерфорд предположил, что электроны вращаются вокруг ядра по отдельным аккуратным орбитам, точно так же, как планеты вращаются вокруг Солнца. Однако, поскольку ядро больше и плотнее электронов, он не мог объяснить, почему электроны просто не были втянуты в ядро, тем самым разрушив атом.
Резерфорд предположил, что электроны вращаются вокруг ядра по отдельным аккуратным орбитам, точно так же, как планеты вращаются вокруг Солнца. Однако, поскольку ядро больше и плотнее электронов, он не мог объяснить, почему электроны просто не были втянуты в ядро, тем самым разрушив атом.
Модель атома Нильса Бора (1885-1962) решила эту проблему, используя информацию Планка. Фотоны испускаются электрически стимулированным атомом только на определенных частотах. Он предположил, что электроны обитают на разных энергетических уровнях, а свет излучается только тогда, когда электрически «возбужденный» электрон вынужден менять энергетические уровни.
Электроны на первом энергетическом уровне, ближайшем к ядру, прочно связаны с ядром и имеют относительно низкую энергию. На уровнях, более удаленных от ядра, электроны имеют возрастающую энергию. Электроны на энергетическом уровне, наиболее удаленном от ядра, связаны не так прочно и являются электронами, участвующими, когда атомы соединяются вместе, образуя соединения. Периодический характер свойств элементов является результатом количества электронов на внешнем энергетическом уровне, которые могут быть вовлечены в химические связи. Хотя модели Бора были заменены более точными атомными моделями, лежащие в их основе принципы верны, и модели Бора по-прежнему используются в качестве упрощенных диаграмм для демонстрации химической связи.
Электроны на энергетическом уровне, наиболее удаленном от ядра, связаны не так прочно и являются электронами, участвующими, когда атомы соединяются вместе, образуя соединения. Периодический характер свойств элементов является результатом количества электронов на внешнем энергетическом уровне, которые могут быть вовлечены в химические связи. Хотя модели Бора были заменены более точными атомными моделями, лежащие в их основе принципы верны, и модели Бора по-прежнему используются в качестве упрощенных диаграмм для демонстрации химической связи.
Наше понимание атома продолжает уточняться. В 1935 году Джеймс Чедвик был удостоен Нобелевской премии за открытие того, что в ядре атома содержится равное количество электрически нейтральных частиц. Поскольку нейтроны электрически нейтральны, они не отклоняются ни электронами, ни протонами. Кроме того, нейтроны имеют большую массу, чем протоны. Сочетание этих фактов позволяет нейтронам проникать в атомы и разрушать ядра, высвобождая огромное количество энергии.



 ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
ck12.org/cbook/ck-12-chemistry-flexbook-2.0/