Электронные акцепторы и доноры — Справочник химика 21
Введение металлов, обладающ,их меньшей электроотрицательностью по сравнению с СиО и поэтому действующих как доноры электронов (щелочные или щелочноземельные металлы), повышает активность и снижает селективность. Электронные акцепторы (С1 , SO , S, Р), напротив, увеличивают селективность и уменьшают активность [74, 75]. [c.97]Третья стадия процессов окисления — передача электронов от донора к акцептору (от реагента к кислороду), в отличие от первых двух, является специфичной для гетерогенного катализа и связывает его с проблемами физики твердого тела. Принципиально проблема подвижности электронов в адсорбционном комплексе не отличается от проблемы подвижности электронов внутри молекулы, поскольку такая подвижность обусловливает реакционную способность системы. Действительно, реакцию окисления какого-либо соединения, например 80-2, на твердом катализаторе можно себе представить в виде [c.28]
Частицы, которые при взаимодействии в данном процессе отдают электроны, называются донорами электронов, а частицы, которые их принимают, — акцепторами электронов.
На основании экспериментальных и лит(«ратурных данных показано влияние типа симметрии донора н сродства к электрону акцептора на стойкость сложных комплексов в диоксане, этил-ацетате, уксусном ангидриде и ацетоне. [c.137]
Так возникают комплексы с переносом заряда [277], характеризующиеся частичным или полным переносом электрона от донора к акцептору [282]. Возникающее полярное состояние имеет ион-радикальную природу [277] и является парамагнитным. [c.285]
Помимо рассмотренного механизма образования ковалентной связи, согласно которому общая электронная пара возникает при взаимодействии двух электронов, существует также особый донорно-акцеп-торный механизм. Он заключается в том, что ковалентная связь образуется в результате перехода уже существующей электронной пары донора (поставщика электронов) в общее пользование донора и акцептора. Донорно-акцепторный механизм хорошо иллюстрируется схемой образования иона аммония (точками обозначены электроны внешнего уровня атома азота) [c.35]
Согласно второй версии, ня первой стадии реакции акцептором электронов от донора-металла является диен, а реакция. завершается присоединением протонов, донором которых является спирт или вода [c.68]
Атом, предоставляющий для связи пару электронов, называют донором. Атом со свободной орбиталью, принимающий эту пару, называют акцептором. Характерными особенностями ковалентной связи являются ее насыщаемость, направленность и поляризуемость. [c.231]
В настоящее время представляет большой интерес изучение молекулярных комплексов электронодонорно-акцепторного типа [Д…..А], т. е. КПЗ. Такой комплекс образуется при взаимодействии электронов молекул донора (Д) и акцептора (А)
Проводимость полупроводников может быть обусловлена нарушением идеальной периодичности кристаллической решетки, например, за счет примесных атомов постороннего вещества, у которого зона проводимости совпадает с запрещенной зоной основного вещества. При этом если атомы примеси отдают свои электроны, то они попадают только в зону проводимости (рис. П1.35, а). Примеси такого типа называются донорами, а сам кристалл называется полупроводником /г-типа. Когда атомы примеси обладают электроно-акцептор-ными свойствами, они захватывают электроны из заполненной зоны, где образуются пустые места, или дырки, куда и попадают электроны проводимости (рис. П1.35, б). Такое вещество называется полупроводником дырочного, или р-типа. [c.203]
Г. Люисом (1923) была предложена электронная теория кислот и оснований, основанная на современных представлениях о природе химической связи, главным образом донорно-акцепторной. По Льюису, кислота — акцептор неподелен-иой пары электронов, т. е. реагент, присоединяющий пару электронов основание — донор электронной пары, т. е. реагент, отдающий пару электронов, например [c.30]
Проявление ковалентной связи в кристаллогидратах. Образование соединений с ковалентным типом связи может происходить не только по обменному механизму, но также и при взаимодействии одного атома или иона с заполненной орбиталью с другим атомом или ионом, имеющим вакантную орбиталь. Такой механизм образования химической связи называется донорно-акцепторным. Атом или ион, поставляющий пару электронов, называют донором, а атом или ион, к которому эта пара электронов перемещается,— акцептором. [c.21]
Акцептор Донор электронов [c.302]
Чтобы уравнять число электронов, отдаваемых донором (5 ) и приобретаемых акцептором (Ы » ), находим наименьшее общее кратное для 3 и 8, оно равно 24, а затем дополнительные множители, которые одновременно являются стехнометрическими коэффициентами перед формулами окислителя и восстановителя в левой части молекулярного уравнения реакции и соответствующих им соединений в правой части уравнений.
Внутри вертикальных линий помещены множители (3 и 8), которые служат для выравнивания чисел электронов, отдаваемых донором их (т. е. частицами 5 -) и приобретаемых акцептором электронов (т. е. частицами Ы +). Эти же числа служат стехиометрическими коэффициентами в молекулярном уравне- [c.52]
Как явствует из их названия, донорно-акцепторные комплексы [29] всегда состоят из двух молекул донора и акцептора. Донор может поставлять либо неподеленную пару электронов (п-донор), либо пару электронов л-орбитали двойной связи или ароматической системы (я-донор). Присутствие такого комплекса можно установить по электронному спектру, такой спектр (наличие полосы переноса заряда) обычно отличается от суммы спектров двух индивидуальных соединений [30]. Поскольку первое возбужденное состояние комплекса относительно близко по энергии основному состоянию, в спектре присутствует пик в видимой или близкой ультрафиолетовой области донорно-акцепторные комплексы часто бывают окрашены. Многие комплексы неустойчивы и существуют только в растворах в равновесии со своими компонентами однако известны и устойчивые комплексы, существующие в твердом состоянии. В большинство комплексов молекулы донора и акцептора входят в соотношении 1 1 или в других соотношениях целых чисел, но известны некоторые комплексы с нецелочисленн
Разница между Донорными и Акцепторными примесями
Основное различие между Донорными и Акцепторными примесями заключается в том, что элементы в группе V периодической таблицы элементов обычно действуют как Донорные примеси (отдающие), тогда как элементы в группе III обычно действуют как Акцепторные примеси (принимающие).
Содержание
- Обзор и основные отличия
- Что такое Донорные примеси
- Что такое Акцепторные примеси
- В чем разница между Донорными и Акцепторными примесями
- Заключение
Что такое Донорная примесь?
Донорные примеси — это донорные (отдающие) химические элементы, добавляемые к полупроводнику для увеличения его электропроводности. Элементы в V группе периодической таблицы элементов являются общими донорными примесями. Донором является атом или группа атомов, которые могут образовывать области n-типа (от англ. «negativ» — что переводится как «отрицательный») при добавлении в полупроводник. Типичным примером является кремний (Si).
 Кремний с Донорной примесью фосфора
Кремний с Донорной примесью фосфораК элементам V группы, которые часто служат в качестве донорных примесей, относятся мышьяк (As), фосфор (P), висмут (Bi) и сурьму (Sb). Эти элементы имеют пять электронов в своей внешней электронной оболочке (у них есть пять валентных электронов). При добавлении одного из этих примесных элементов к кремнию, образуется четыре ковалентные связи.
Но теперь есть свободный электрон, так как было пять валентных электронов. Этот электрон так и останется свободным электроном, что увеличит проводимость полупроводника. Число примесных атомов определяет количество свободных электронов, присутствующих в доноре.

Что такое Акцепторная примесь?
Акцепторная примесь представляют собой акцепторные (принимающие) химические элементы, добавляемые в полупроводник для увеличения его электропроводности. Элементы в III группе периодической таблицы элементов используются в качестве акцепторных примесей. Эти элементы включают алюминий (Al), бор (B) и галлий (Ga). Акцептор представляет собой легирующую примесь, которая образует области р-типа (от англ. «positiv» — что переводится как «положительный») при добавлении в полупроводник. Атомы акцепторных примесей имеют три валентных электрона в своих внешних электронных оболочках.
 Кремний с Акцепторной примесью бора
Кремний с Акцепторной примесью бораПри добавлении в полупроводник акцепторного атома примеси, например такого как алюминий, он заменяет атомы кремния в полупроводнике. Перед этим атом кремния имеет вокруг себя четыре ковалентные связи. Когда атом алюминия занимает положение кремния, этот атом алюминия образует только три ковалентные связи, что, в свою очередь, приводит к образованию свободной вакансии ковалентной связи у соседних атомов. Эта свободная вакансия называется дыркой. Из соседней ковалентной связи на место свободной дырки может перескочить электрон. Эти дырки используются при прохождении электричества через полупроводник. При прохождении электричества в полупроводнике происходит хаотическое блуждание дырок.
Когда число добавленных примесных атомов увеличивается, число дырок, присутствующих в полупроводнике, также увеличивается. Это добавление примеси, увеличивает проводимость в полупроводнике. После завершения процесса легирования полупроводник становится внешним (легированным) полупроводником.
В чем разница между Донорными и Акцепторными примесями?
| Донорные против Акцепторных примесей | |
| Донорные примеси — это донорные элементы, добавляемые к полупроводнику для увеличения его электропроводности | Акцепторные примеси представляют собой акцепторные элементы, добавляемые к полупроводнику для увеличения его электропроводности |
| Распространенные примеси | |
| Элементы V группы | Элементы III группы |
| Примеры примесей | |
| Мышьяк (As), фосфор (P), висмут (Bi) и сурьма (Sb) | Алюминий (Al), бор (B) и галлий (Ga) |
| Процесс | |
| Увеличение свободных электронов в полупроводнике | Увеличение дырок в полупроводнике |
| Валентные Электроны | |
| Атомы имеют пять валентных электронов | Атомы имеют три валентных электрона |
| Ковалентное соединение | |
| Образует четыре ковалентные связи внутри полупроводника, оставляя пятый электрон в качестве свободного электрона | Образует три ковалентные связи внутри полупроводника, оставляя дырку, где ковалентная связь отсутствует |
Заключение — Донорные против Акцепторных примесей
Полупроводники — это материалы, занимающие промежуточное место между диэлектриками, который не является проводником, и проводниками. Доноры и Акцепторы — это легирующие примеси, которые образуют проводящие электрический ток области в полупроводниках. Легирование Донором или Акцептором — это процессы, которые увеличивают электропроводность полупроводника. Основное различие между Донорными и Акцепторными примесями заключается в том, что элементы в III группе периодической таблицы действуют как Донорные примеси, тогда как элементы в V группе действуют как Акцепторные примеси.
Примеси и примесные уровни в полупроводниках. Доноры и акцепторы.
Реальные твердые тела содержат примеси, которые появляются в результате специального легирования, либо неконтролируемым образом. Наличие дефекта приводит к нарушению идеальной периодичности одноэлектронного потенциала электрона в кристалле. Это нарушение может быть описано введением дополнительной потенциальной энергии, локализованной в месте расположения дефекта.
В приближении
эффективной массы необходимо решить
уравнение типа (1.56), где  — потенциал примесного иона, действующий
на электрон. Рассмотрим, для определенности
примесный атом элемента V
группы периодической таблицы, замещающий
атом IV-валентного
полупроводника. Четыре электрона примеси
участвуют в образовании ковалентной
связи с четырьмя ближайшими соседями.
Пятый электрон оказывается в кристалле
полупроводника, в котором на место
нейтрального исходного атома помещен
однократно положительно заряженный
ион. Если принять, что поле иона примеси,
действующее на «лишний» электрон
кулоновское, то в приближении эффективной
массы получаем водородоподобную задачу.
Эффективная масса зонного электрона,
однако, отличается от массы свободного
электрона (обычно в меньшую сторону).
Кроме того, радиус волновой функции
связанного состояния достаточно велик
(охватывает несколько постоянных
решетки). Это приводит к необходимости
учета экранирования кулоновского поля
иона примеси посредством введения
диэлектрической проницаемости
полупроводника
— потенциал примесного иона, действующий
на электрон. Рассмотрим, для определенности
примесный атом элемента V
группы периодической таблицы, замещающий
атом IV-валентного
полупроводника. Четыре электрона примеси
участвуют в образовании ковалентной
связи с четырьмя ближайшими соседями.
Пятый электрон оказывается в кристалле
полупроводника, в котором на место
нейтрального исходного атома помещен
однократно положительно заряженный
ион. Если принять, что поле иона примеси,
действующее на «лишний» электрон
кулоновское, то в приближении эффективной
массы получаем водородоподобную задачу.
Эффективная масса зонного электрона,
однако, отличается от массы свободного
электрона (обычно в меньшую сторону).
Кроме того, радиус волновой функции
связанного состояния достаточно велик
(охватывает несколько постоянных
решетки). Это приводит к необходимости
учета экранирования кулоновского поля
иона примеси посредством введения
диэлектрической проницаемости
полупроводника  в потенциальную энергию взаимодействия
электрона с ионом примеси. Таким образом,
уравнение водородоподобной задачи для
электрона простого донорного центра
замещения имеет вид
в потенциальную энергию взаимодействия
электрона с ионом примеси. Таким образом,
уравнение водородоподобной задачи для
электрона простого донорного центра
замещения имеет вид
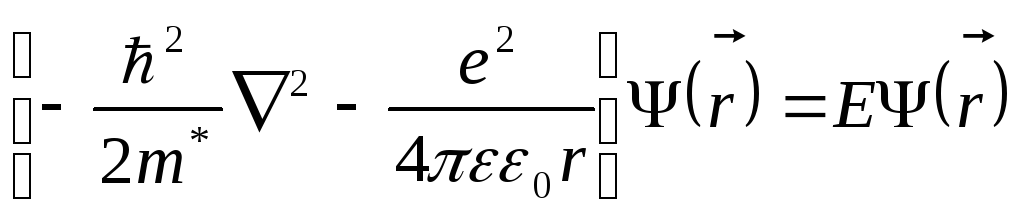 ,
(1.69)
,
(1.69)
и
энергия связанного состояния, отсчитанная
от дна зоны проводимости, принимает
значения:  (1.70)
(1.70)
Энергия ионизации
донорной примеси составляет 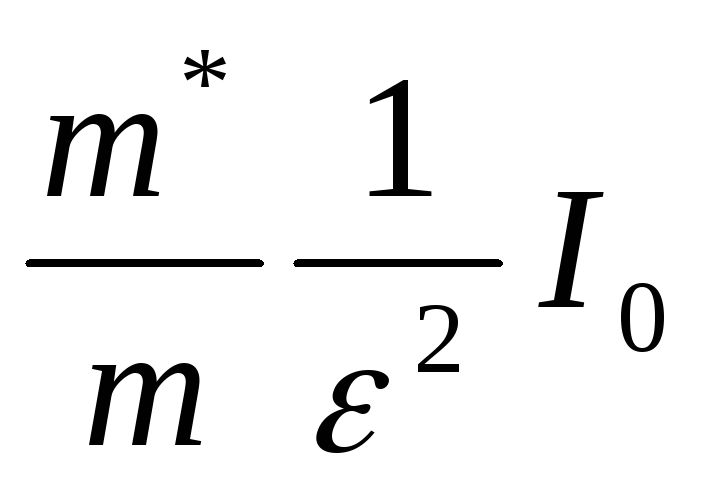 , где
, где 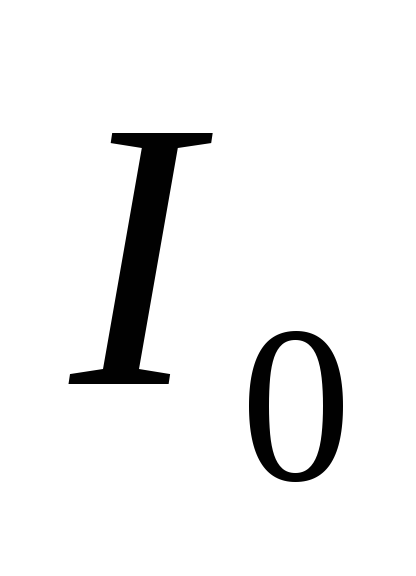 — энергия ионизации атома водорода, и
составляет величину порядка 0,006 эВ в
Ge,
0,025 эВ в Si
и 0,007 эВ в GaAs.
— энергия ионизации атома водорода, и
составляет величину порядка 0,006 эВ в
Ge,
0,025 эВ в Si
и 0,007 эВ в GaAs. Размер первой боровской орбиты
определяется соотношением
Размер первой боровской орбиты
определяется соотношением
 (1.71)
(1.71)
Оценки радиуса
локализованного состояния мелкого
донора в Ge
и Si
дают значения 64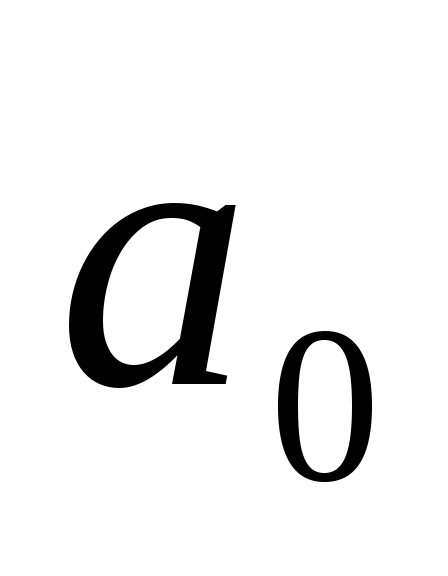 и 30
и 30 ,
соответственно.
,
соответственно.
Пусть теперь один из атомов четырехвалентного основного вещества замещается трехвалентным атомом, например, атом кремния атомом Бора. Три валентных электрона Бора образуют связи с соседними атомами кремния, однако четвертая связь остается незаполненной (не хватает одного электрона). Эта незаполненная связь локализована на примесном центре. Однако, если из состояния валентной зоны добавить на эту связь электрон, то центр превратится в отрицательно заряженный ион квазиосновного вещества и при этом появится дырка в валентной зоне. Эта дырка притягивается к отрицательно заряженному иону примеси и может иметь связанные состояния с уровнями энергии, лежащими в запрещенной зоне (отсчет энергий для дырок производится от вершины вглубь валентной зоны. Уравнение движения дырки в приближении эффективной массы в кулоновском поле примеси является водородоподобным и имеет решения для энергии (отсчет от вершины валентной зоны вглубь запрещенной зоны.
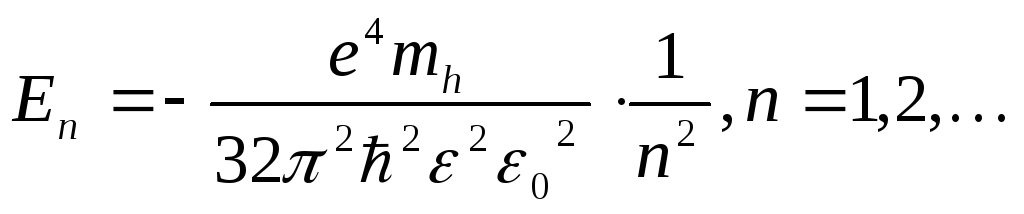 (1.72)
(1.72)
Основной уровень дырки на примесном центре должен находиться на расстоянии примерно 0,015 эВ в Ge, 0,05 эВ в Si и 0,05 эВ в GaAs. Дырка в связанном состоянии локализована на примесном центре в области радиуса боровской орбиты. Однако, если ей сообщить энергию, равную энергии связи, то она становится зонной и делокализуется по всему кристаллу. Поскольку энергия связи дырки на центре мала, то уже при комнатных температурах она легко переходит в свободное зонное состояние. Примесный центр, который легко отдает дырку в валентную зону, называется акцептором. Из формул (1.70), (1.72) следует, что у донора и акцептора наряду с основным уровнем, существуют возбужденные состояния. Эти состояния были обнаружены при исследовании поглощения инфракрасного излучения.
Предположение о том, что примеси не влияют друг на друга и их можно описывать независимо справедливо только при их относительно низких концентрациях (меньших 1016 см-3 ). При больших концентрациях волновые функции примесных центров начинают перекрываться и вместо одиночных примесных уровней получается примесная зона. Волновая функция частицы в такой зоне представляет собой суперпозицию волновых функций, центрированных на отдельных примесных центрах. В данном случае уже нельзя сказать, что электрон или дырка локализован на данной примеси – они принадлежат всему кристаллу. При еще более высокой концентрации примесей интегралы перекрытия превзойдут энергию ионизации примесных центров. Примесные зоны сливаются с обычной зоной, от которой отщепились примесные уровни в случае малой концентрации центров.
 Упрощенная
водородоподобная модель не позволяет
точно рассчитать энергии уровней
различных примесных центров в
полупроводниках. Особенно это относится
к глубоким примесным уровням, что видно
из
Упрощенная
водородоподобная модель не позволяет
точно рассчитать энергии уровней
различных примесных центров в
полупроводниках. Особенно это относится
к глубоким примесным уровням, что видно
из
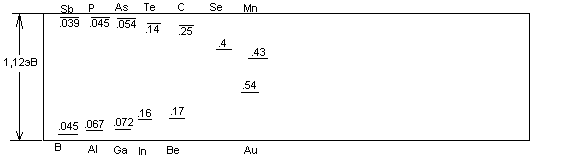
экспериментальных данных, приведенных на рис 1.8
Рис 1.8 Значения энергии ионизации различных примесных состояний в Si
Метод эффективной массы оказывается неприменимым в задаче об уровнях, лежащих глубоко в запрещенной зоне. Такие уровни возникают в случае вакансии иона в кристалле, или при замещении или внедрении атомов вещества, резко отличающихся по свойствам от атомов основного материала.
Отсутствие отрицательного иона в решетке эквивалентно наличию локализованного положительного заряда. Электрон испытывает притяжение к центру мощного короткодействующего потенциала. Оценки показывают, что радиус волновой функции в данном случае порядка нескольких постоянных решетки. Электрон уже не «чувствует» кристаллического потенциала, в данном случае лучше работает приближение примесной молекулы. В этом приближении диэлектрическая проницаемость принимается равной единице (нет экранирования электрического поля), электрон берется с обычной массой свободной частицы, потенциал, действующий на электрон, аппроксимируется параболической или прямоугольной ямой. Для рассматриваемой квазимолекулы важным является адиабатическое приближение, позволяющее разделить электронную и ионную задачи. Вид адиабатического потенциала и положение его минимума зависит от энергии электронного уровня. При быстрых электронных переходах в F-центрах выполняется адиабатический принцип – переход происходит без изменения ионных координат.
Оптические
явления с участием глубоких примесных
уровней могут быть рассмотрены в модели
короткодействующего потенциала,
использованного Бете для процесса
фоторасщепления дейтрона под действием  -излучения.
Если рассматриваются переходы из
связанного состояния в зонные (или
свободные) с малыми значениями
квазиимпульса (вблизи порога фотоионизации),
то в Фурье-разложении примесной волновой
функции важны гармоники с малыми
волновыми векторами, что отвечает
поведению функции в координатном
представлении на больших расстояниях
от центра. Поэтому становится важной
асимптотическая часть функции вдали
от центра, а не вблизи сердцевины. Модель
потенциала нулевого радиуса может быть
многозонной, однако, обычно используется
однозонное или двухзонное приближение.
-излучения.
Если рассматриваются переходы из
связанного состояния в зонные (или
свободные) с малыми значениями
квазиимпульса (вблизи порога фотоионизации),
то в Фурье-разложении примесной волновой
функции важны гармоники с малыми
волновыми векторами, что отвечает
поведению функции в координатном
представлении на больших расстояниях
от центра. Поэтому становится важной
асимптотическая часть функции вдали
от центра, а не вблизи сердцевины. Модель
потенциала нулевого радиуса может быть
многозонной, однако, обычно используется
однозонное или двухзонное приближение.
Будем искать решение уравнения (1.48) в виде разложения (1.49)
При этом получим 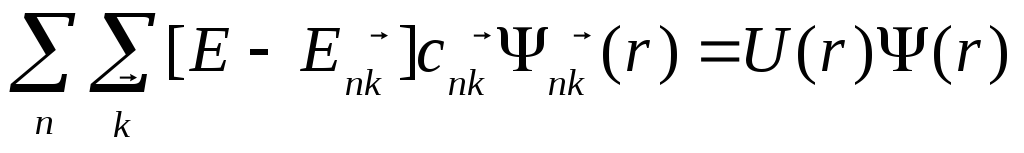 (1.73)
(1.73)
где  — короткодействующий потенциал примесного
центра. Умножая (1.73) слева на
— короткодействующий потенциал примесного
центра. Умножая (1.73) слева на 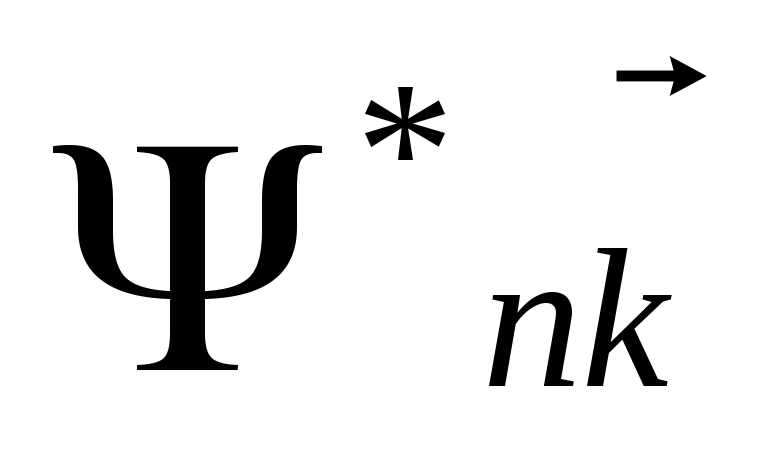 и интегрируя, получим
и интегрируя, получим
 (1.74)
(1.74)
где 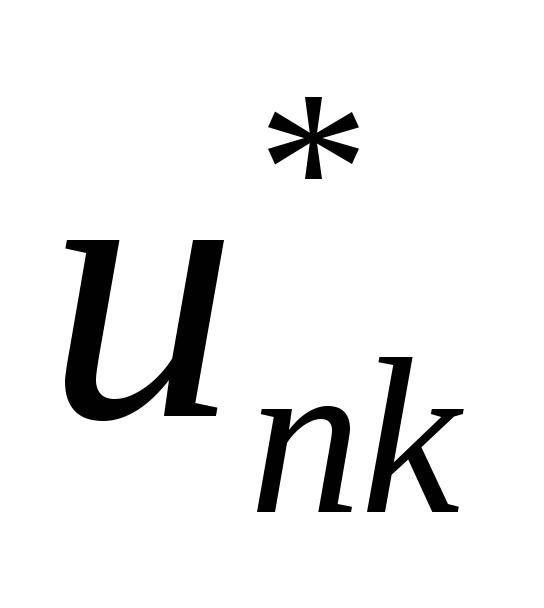 — блоховская амплитуда. Соотношение
(1.74) точное, справедливое для любого
потенциала. Считая потенциал
короткодействующим, с радиусом действия
r0, замечаем, что для kr0 <<1
экспоненту под знаком интеграла в (1.74)
можно положить равной единице. Обозначая
— блоховская амплитуда. Соотношение
(1.74) точное, справедливое для любого
потенциала. Считая потенциал
короткодействующим, с радиусом действия
r0, замечаем, что для kr0 <<1
экспоненту под знаком интеграла в (1.74)
можно положить равной единице. Обозначая 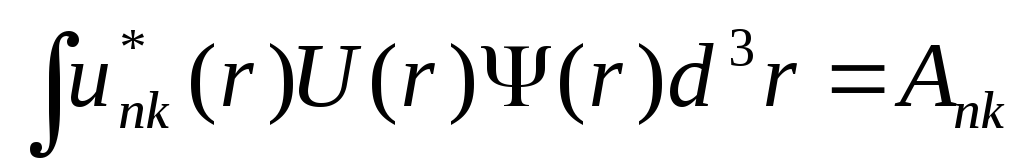
Получим 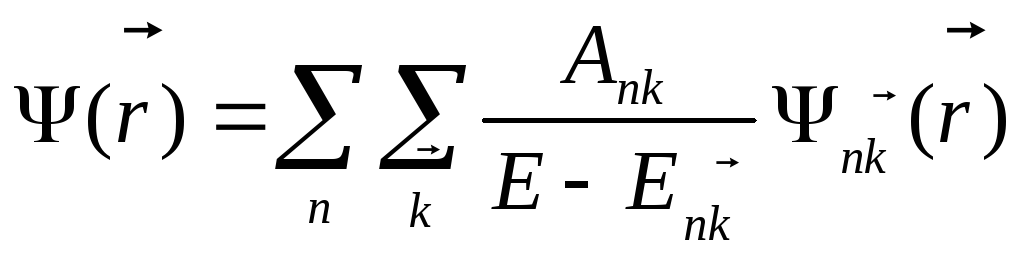 (1.75)
(1.75)
Соотношение (1.75) позволяет рассчитать вероятности оптических переходов с глубокого примесного уровня в зону. Поскольку переход происходит в зонное блоховское состояние, использование условия ортонормированности блоховских функций снимает суммирование, и результат получается в виде аналитического выражения, содержащего зонные параметры и частоту излучения.
Донор (физика) — Википедия
Материал из Википедии — свободной энциклопедии
У этого термина существуют и другие значения, см. Донор.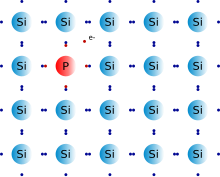
Донор в физике твёрдого тела (см. также полупроводники) — примесь в кристаллической решётке, которая отдаёт кристаллу электрон. Вводится при ковалентном типе связи. Бывают однозарядные и многозарядные доноры. Например, в кристаллах элементов IV группы периодической системы элементов (кремнии, германии) однозарядными донорами являются элементы V группы: фосфор, мышьяк, сурьма. Так как элементы пятой группы обладают валентностью 5, то четыре электрона образуют химическую связь с четырьмя соседними атомами кремния в решётке, а пятый электрон оказывается слабо связанным (энергия связи порядка нескольких сотых электрон-вольта) и образует так называемый водородоподобный примесный центр, энергию которого просто оценить из решения уравнения Шрёдингера для атома водорода, принимая во внимание, что электрон в кристалле — квазичастица и его эффективная масса отличается от массы электрона, а также, что электрон движется не в вакууме, а в среде с некой (порядка 10) диэлектрической проницаемостью.
Атомы донорных примесей, которые вводятся в полупроводник и отдают ему один или несколько электронов, создают избыток электронов и формируют так называемый полупроводник n-типа. Атом донора удерживает лишний электрон слабо, и при достаточной температуре этот электрон может перейти в зону проводимости и участвовать в электропроводности кристалла.
Дополнительный электрон, связанный с атомом донора, образует так называемый донорный уровень в запрещенной зоне. Донорный уровень называется мелким, если его энергия (отсчитываемая от дна зоны проводимости) сравнима с характерной энергией теплового движения при комнатной температуре kbT{\displaystyle k_{b}T}, где T{\displaystyle T} — температура, а kB{\displaystyle k_{B}} — постоянная Больцмана. Эта энергия составляет примерно 26 мэВ. Мелкими донорами могут быть не только примесные атомы, но и комплексы структурных дефектов (например т. н. термодоноры в кремнии). Многие примеси и точечные дефекты, (например золото и медь в кремнии, вакансии, являются глубокими донорами. В отличие от мелких доноров, они слабо влияют на удельное электросопротивление, но существенно снижают время жизни неравновесных носителей заряда.
Лишний электрон притягивается кулоновской силой к иону донора, который имеет избыточный положительный заряд по сравнению с атомами полупроводника. Вследствие такого притяжения донорные уровни образуют водородоподобную серию с энергиями, которые можно рассчитать по формуле
- Ed=EC−RHme∗/m0ε21n2{\displaystyle E_{d}=E_{C}-R_{H}{\frac {m_{e}^{*}/m_{0}}{\varepsilon ^{2}}}{\frac {1}{n^{2}}}}
где Ed{\displaystyle E_{d}} — энергия донорного уровня, EC{\displaystyle E_{C}} — энергия дна зоны проводимости, RH{\displaystyle R_{H}} — постоянная Ридберга (примерно 13,6 эВ), me∗{\displaystyle m_{e}^{*}} — эффективная масса электрона, m0{\displaystyle m_{0}} — масса свободного электрона, ε{\displaystyle \varepsilon } — диэлектрическая проницаемость полупроводника, а n — целое число, которое может принимать значения от единицы до бесконечности, но практически важны лишь несколько самых низких уровней с малыми n.
Благодаря тому обстоятельству, что эффективные массы электронов в полупроводниках малы, а диэлектрические проницаемости довольно большие (порядка 10), энергия донорных уровней мала, а радиусы локализации соответствующих волновых функций довольно большие ~10 нм, распространяются на несколько периодов кристаллической решетки.
- Ансельм А. И. Введение в теорию полупроводников. — 2-е изд., доп. и перераб.. — М.: Наука, 1978. — 615 с.
Примесные полупроводники | Kursak.NET
Большинство полупроводниковых приборов изготовляют на основе примесных полупроводников.
Кристаллы полупроводников неизбежно в реальных условиях обладают определенным количеством посторонней примеси, даже если требуется получить материал очень высокой степени чистоты.
Примеси также специально вводятся во время роста кристаллов с целью получить полупроводник с заданными электрическими свойствами, при изготовлении приборных структур. Такие полупроводники называются легированными или примесными.
Примеси могут быть донорного и акцепторного типа.
ДОНОР – это примесный атом или дефект кристаллической решетки, способный в возбужденном состоянии отдать электрон в зону проводимости.
АКЦЕПТОР – это примесный атом или дефект кристаллической решетки, свободный от электрона в невозбужденном состоянии и способный захватить электрон из валентной зоны в возбужденном состоянии.
Рис.3.3. Донорная 5-и валентная (As, Sb) и акцепторная 3-х валентная (In, B) примеси
При небольшой концентрации примесей (~1 на 10 6 ) их атомы расположены в полупроводнике на таких больших расстояниях друг от друга, что не взаимодействуют между собой.
Вероятность непосредственного перехода электронов от одного примесного атома к другому ничтожно мала, т. е. с точки зрения зонной теории не происходит расщепления примесных уровней.
Атомы примеси, отличаясь от атомов основного кристалла валентностью, создают уровни разрешенных энергий электронов в запрещенной зоне, которые либо могут поставлять электроны в зону проводимости, либо принимать на себя электроны из валентной зоны
Рис.3.4 Зонные диаграммы примесных полупроводников
Доноры и акцепторы имеют энергетические уровни в запрещенной зоне собственного п/п.
Энергиия ионизации донора минимальная энергия, которую необходимо сообщить электрону, находящемуся на донорном уровне, чтобы перевести его в зону проводимости.
Энергия ионизации акцептора — это минимальная энергия, которую необходимо сообщить электрону валентной зоны, чтобы перевести его на акцепторный уровень.
Энергия ионизации примесных атомов значительно меньше энергии ионизации собственных атомов полупроводника или ширины запрещенной зоны. Поэтому в примесных полупроводниках при низких температурах преобладают носители заряда, возникшие из-за ионизации примесей.
Если электропроводность полупроводника обусловлена электронами, его называют полупроводником n-типа, если электропроводность обусловлена дырками — полупроводником р-типа.
Связи химические акцептор донор ные
СЕМИПОЛЯРНАЯ СВЯЗЬ (координационная, донорно-акцепторная связь) — тип химической связи, образование которой можно представить как присоединение к свободной электронной паре атома (донора) другого атома или группы атомов (акцептора), имеющего секстет валентных электронов. С. с. встречается чаш,е всего в комплексных и органических соединениях. Типичным примером С. с. в органических соединениях является связь N—О [c.222]Мы видим, что электронная теория Льюиса рассматривает нейтрализацию в водных растворах, взаимодействие аммиака с галогенидами бора, комплексообразование, реакции ангидридов с водой как сходные процессы. Действительно, с точки зрения теории химической связи во всех этих процессах взаимодействие между частицами имеет одинаковую природу — образуется донорно-акцепторная ковалентная связь. Вещества, являющиеся донорами электронных пар, часто называют основаниями по Льюису, акцепторы электронных пар — кислотами по Льюису. [c.252]
Таким образом, электронная теория Льюиса рассматривает нейтрализацию в водных растворах, взаимодействие аммиака с галогенидами бора, комплексообразование, реакции ангидридов с водой как сходные процессы. Действительно, согласно теории химической связи, во всех этих процессах взаимодействие между частицами имеет одинаковую природу — образуется донорно-акцепторная связь. Вещества, являющиеся донорами электрон] ых пар, часто называют основаниями Льюиса, а акцепторы электронных пар — кислотами Льюиса или L-кислотами. Большинство катионов является L-кислотами, а анионов — льюисовскими основаниями. Соли — типичные кислотно-основные комплексы. Мы видим, что теория Льюиса рассматривает вопрос о кислотах и основаниях более широко, чем другие теории. [c.241]
КООРДИНАЦИОННАЯ СВЯЗЬ (донорно-акцепторная связь), химическая связь, реализующаяся в координац. (комплексных) соединениях. Характерная особенность этих соединений — наличие группировок, в к-рых число связей, образуемых центральными атомами, превышает их формальную высшую валентность. Возникновение К, с. обусловлена передачей электронной пары с целиком заполненной орбитали лиганда (донора) на вакантную орбиталь центрального атома (акцептора) и образованием общей связывающей молекулярной орбитали. Следовательно, природа К. с. ве отличается от природы обычной полярной ковалентной свя- [c.275]
Огромную роль в межмолекулярных взаимодействиях играет водородная связь, поскольку ею в значительной мере определяется возможность образования комплексов, мицелл и ассоциаций молекул в объеме масла и на поверхности металлов. Межмолекулярная водородная связь зависит от электростатических и донорно-акцепторных взаимодействий между молекулами—донором (АН) и акцептором (В) водорода. Энергия водородной связи по величине (8—60 кДж/моль) уступает энергии химических связей, но именно она в межмолекулярных связях во многом определяет ассоциацию молекул воды, спир- [c.203]
Образование химических связей по донорно-акцепторному механизму — весьма распространенное явление при химических реакциях. Рассмотрим еще пример образования такой связи при взаимодействии молекулы ВНз с гидрид-ионом Н». В молекуле ВНз имеется вакантная р-орбиталь, а у гидрид-иона — неподеленная пара электронов, поэтому молекула ВНз служит акцептором, а ион Н» — донором. Схему образования химической связи по донорно-акцепторному механизму при взаимодействии молекулы ВНз с ионом Н можно записать в виде [c.47]
Следует особо подчеркнуть, что, хотя образование новой связи происходит за счет пары электронов иона ОН , который, таким образом, выступает в роли донора электронной пары, образуется не донорно-акцепторная, а истинная ковалентная связь. Это связано с тем, что атом углерода не является акцептором и приобретает акцепторные свойства лишь в момент химического превращения, передавая один из своих электронов образующемуся иону Г. Поэтому избыточный электрон, получаемый им от ОН , лишь восстанавливает его исходное состояние четырехвалентного атома. [c.15]
Из этого примера видно, что ион водорода присоединяется к уже готовой электронной паре, принадлежащей до реакции только одному из соединяющихся элементов — азоту. Следовательно, химическая связь, осуществляемая за счет неподеленной пары электронов одного атома и свободной квантовой ячейки другого, называ-е 1ся координативной, или донорно-акцепторной. Атом или ион, предоста1Вляющий неподеленную электронную пару, называется донором, а присоединяющийся к этой электронной паре — акцептором. В ионе аммония МН4]+ донором является атом азота, а акцептором — ион водорода. Ион, образованный за счет координативной связи, называется комплексным ионом, а соединения, содержащие подобные ионы, — комплексными соединениями. [c.81]
Валентнонасыщенные молекулы могут образовать между собой химические соединения за счет донорно-акцепторного взаимодействия. Такое взаимодействие обусловлено наличием вакантной АО в одном из атомов акцептора и неподеленной пары электронов на АО одного из атомов молекулы донора. Донорно-акцепторная связь по своей природе ковалентна, так как осуществляется парой электронов, общей двум атомам. [c.57]
Особым видом ковалентной связи является так называемая координационная, или донорно-акцепторная связь. Координационной называется связь между атомами, один из которых — донор — имеет заполненную внешнюю атомную орбиту (как говорят, имеет неподеленную пару электронов, т. е. пару электронов, не принимающих участия в образовании других химических связей), а второй — акцептор — имеет пустую, не содержащую ни одного электрона, внешнюю атомную орбиту, В молекуле этим двум атом- [c.12]
Электронная теория. Согласно электронной теории, разработанной Льюисом, основание — это соединение, поставляющее электронные пары для образования химической связи, т. е. донор электронных пар кислота — вещество, принимающее электронные пары, т. е. акцептор электронных пар. Кислотноосновное взаимодействие согласно электронной теории заключается в образовании донорно-акцепторной связи. В результате взаимодействия кислоты с основанием образуются солеподобные вещества, называемые аддуктами. Часто (но не всегда) их удается выделить как индивидуальные соединения. [c.301]
Донором или акцептором водорода может быть как растворитель, так и неподвижная фаза. С
Акцепторы и доноры протонов — Справочник химика 21
Крезол обладает только кислыми свойствами, пиридин только основными. Таким образом, для каталитической мутаротации глюкозы необходимо одновременное присутствие и кислоты (донора протонов), и основания (акцептора протонов). Вода может быть и акцептором, и донором протона [c.288]Протолитические растворители можно разделить на три группы. Первую группу составляют амфотерные, которые легко проявляют как способность к присоединению протона, так и способность к его выделению, т. е. они могут быть и акцепторами и донорами протонов. По существу говоря, каждый растворитель в соответствующих условиях может проявлять и донорные и акцепторные свойства. Под амфотерными понимают такие растворители, у которых соотношение донорных и акцепторных свойств мало отличается от их соотношения в воде к ним относятся спирты, фенолы и др. [c.320]
Обычно жидкости первой и второй групп смешиваются между собой, хорошо растворяют многие вещества, легко образуя водородные связи в качестве акцепторов и доноров протонов. [c.221]
В амфипротных растворителях, которые приблизительно в одинаковой степени являются акцепторами и донорами протонов, диссоциируют и кислоты, и основания. [c.92]
Резкого изменения в относительной силе кислот можно ожидать при переходе от растворителей, которые могут быть акцепторами и донорами протонов (вода, спирты), к растворителям, которые обычно являются только акцепторами протона (кетоны, нитрилы, нитросоединения). В этих последних карбоновые кислоты и фенолы образуют соединения одного состава — АВ. В гидроксилсодержащих растворителях фенолы образуют соединения состава АВ, а карбоновые кислоты — состава АВд (см. гл. V). [c.292]
СОСТОЯНИИ или в индифферентном растворителе вещество одновременно может быть и акцептором и донором протонов. Хорошо известным примером таких веществ является вода, которая может дать равновесную систему с участием двух ее молекул [c.140]
Наиболее резкое изменение в относительной силе кислот можно ожидать при переходе от растворителей, которые могут быть акцепторами и донорами протонов (вода, спирты), к растворителям, у которых акцепторные свойства преобладают над донорными (кетоны, нитрилы, нитросоединения). [c.35]
Таким образом, происходящая реакция сводится к образованию промежуточного ацилфермента, а затем к переносу ациль-ного остатка к молекуле воды, если протекает гидролиз, или к иному акцептору ацетильной группы. Серии, конечно, содержится в активном центре не всех ферментов. Так, например, у рибонуклеазы его нет, и в этом ферменте, как предполагается, два остатка гистидина выполняют функцию акцептора и донора протонов. Серии и гистидин, несомненно, являются не единственными остатками, необходимыми для работы активного центра. Имеются факты, говорящие об участии триптофана в активных центрах химотрипсина, трипсина, лизоцима, однако об этом пока еще известно мало. [c.84]
В некоторых органических растворителях (пиридине, хлороформе, ж-крезоле) при полном отсутствии воды мутаротация полностью прекращается. Однако в смеси одной части пиридина с двумя частями л-крезола мутаротация протекает в 20 раз быстрее, чем в воде. л-Крезол обладает только кислыми свойствами, пиридин только основными, таким образом, для каталитической мутаротации глюкозы необходимо одновременное присутствие и кислоты (донора протонов), и основания (акцептора протонов). Вода может быть и акцептором, и донором протона [c.368]
Неионогенное в водном растворе может быть только акцептором протонов Неионогенное в водном растворе может быть акцептором и донором протонов Ионогенное в водном растворе может быть донором и реже акцептором протонов [c.217]
В гомогенных модельных системах этот механизм катализа трудно реализуем по нескольким причинам. Во-первых, в растворе эффективный акцептор и донор протона немедленно обмениваются протоном без участия субстрата, что ограничивает эффективность пуш-пульных механизмов в растворе. Во-вторых, необходимые для катализа взаимные ориентации молекул обычно не отвечают равновесному строению жидкости, когда донор и акцептор протонов располагаются достаточно далеко от необходимых мест передачи протона [c.269]
Растворы, содержащие как акцептор протонов (основание В), так и донор протонов (кислоту ВН), проявляют буферные свойства одновременно по отношению к сильным кислотам и основаниям. Свойство быть одновременно акцептором и донором протонов называется амфотерностью. Амфотерностью могут обладать и растворы индивидуальных веществ (например, растворы кислых солей многоосновных кислот — КаНСОз, Ка2НР04, МаНаР04, в которых анионы являются одновременно донорами и акцепторами протонов). Поэтому растворы таких солей обладают буферными свойствами. [c.186]
Так, по Льюису, кислоты и основания — это вещества, являющиеся акцепторами и донорами протонов соответственно. Атомы азота в аммиаке располагают свободной парой электронов, поэтому аммиак выступает в качестве донора этой пары и является основанием. Бор в ВС1з имеет вакантные места для присоединения пары электронов, поэтому B I3 представляет собой кислоту. Приведенное ниже уравнение иллюстрирует взаимодействие между B I3 и Nh4 [c.87]
Как полагают Меклер и Идлис, «обязательный компонент любой А-А-связи — водородная связь, образующаяся между полярной группой боковой цепи одного аминокислотного остатка и карбонилом остова полипептидной цепи — компонентом аминокислотного остатка-партнсра» [352. С. 43]. Вокруг таких водородных связей имеются гидрофобные рубашки, «защищающие их от атаки молекулами растворителя, в первую очередь, воды. Таким образом Природа обеспечивает образование особых, ранее неизвестных, специфических связей между аминокислотами — Л-Л-связей» [352. С. 44]. Из описанной структурной модели A-A-комплекса, однотипной для всех 26 пар аминокислотных остатков, не ясно, почему водородная связь является «обязательным компонентом любой A-A-связи». Это исключено по целому ряду причин. Во-первых, стабилизирующая энергия водородной связи, даже если она экранирована от контактов с водой, во много раз уступает суммарной энергии других видов невалентных взаимодействий, прежде всего, дисперсионной энергии. Во-вторых, точечное взаимодействие двух атомов этого «обязательного компонента» не может обеспечить стереокомплементарность остатков А и A. Напротив, как хорошо известно [353], взаимное расположение групп С

