Донорно-акцепторый механизм образования ковалентной связи
Перекрывание двух одноэлектронных атомных орбиталей — не единственный путь возникновения ковалентной связи. Атомы азота, кислорода, галогенов и некоторых других элементов в своих ковалентных соединениях имеют завершённые октеты, хотя не все орбитали их внешнего квантового слоя участвуют в образовании связей. Эти орбитали содержат n-электроны (nonbonding — не связывающие электроны) или неподелённые электронные пары (НЭП):
|
Парами несвязывающих электронов при написании структурных формул обычно пренебрегают, однако их необходимо иметь в виду, т.к. они играют важную роль в проявлении химических свойств соединений. В частности, НЭП ответственны за способность веществ вступать во взаимодействие, при котором ковалентная связь образуется за счёт неподелённой электронной пары только одного партнёра (донора электронов), другой же атом (акцептор электронов) должен предоставить вакантную орбиталь. Это равносильно потере одного электрона донором и приобретению его акцептором, поэтому атомы, являющиеся партнёрами в образовании этой связи, меняют свои заряды.
В частности, НЭП ответственны за способность веществ вступать во взаимодействие, при котором ковалентная связь образуется за счёт неподелённой электронной пары только одного партнёра (донора электронов), другой же атом (акцептор электронов) должен предоставить вакантную орбиталь. Это равносильно потере одного электрона донором и приобретению его акцептором, поэтому атомы, являющиеся партнёрами в образовании этой связи, меняют свои заряды.
Образованная таким путём ковалентная связь называется донорно-акцепторной, координационной или координативной. Существует четыре типа взаимодействия частиц, приводящих к образованию донорно-акцепторной связи.
1. Связь возникает при взаимодействии свободной орбитали катиона и НЭП аниона. Взаимодействуя друг с другом, обе частицы утрачивают заряды и образуют нейтральную молекулу.
Примеры:
а) взаимодействие гидроксид-иона и катиона водорода (протона):
б) взаимодействие бромид-аниона и метильного карбокатиона (карбокатионами называются органические катионы, имеющие положительный заряд на атоме углерода; carbon — углерод)
в) взаимодействие метильного карбокатиона и метильного карбаниона
2. Связь образуется при взаимодействии катиона (акцептор электронов) и нейтральной молекулы, имеющей во внешнем квантовом слое атомную орбиталь, несущую НЭП (донор электронов). Получается катион, у которого положительный заряд формально принадлежит атому-донору (фактически он распределяется по всей частице):
Связь образуется при взаимодействии катиона (акцептор электронов) и нейтральной молекулы, имеющей во внешнем квантовом слое атомную орбиталь, несущую НЭП (донор электронов). Получается катион, у которого положительный заряд формально принадлежит атому-донору (фактически он распределяется по всей частице):
Оба взаимодействующих атома поменяли заряды: атом В, передав электрон катиону, зарядился положительно, катион А+, получив электрон, нейтрализовал свой заряд. Суммы зарядов в левой и правой частях уравнения одинаковы.
Формулы Льюиса позволяют подсчитать заряды на атомах, образующих донорно-акцепторные связи. Для этого предложена эмпирическая формула:
Z = G – N – B,
где Z — заряд атома, G — номер группы (число валентных электронов), N — число электронов НЭП, В — число двухэлектронных связей.
В качестве примеров можно привести различные реакции протонирования (присоединения протона к какой-либо частице — донору электронов):
а) протонирование молекулы аммиака
Заряд атома азота в катионе аммония Z N = 5-0-4 = +1.
Координационную связь можно изобразить в виде стрелки, направленной от донора к акцептору:
Однако в действительности все четыре связи в ионе аммония совершенно не различимы.
б) протонирование молекулы воды
Заряд атома кислорода в катионе гидроксония: ZO = 6-2-3= +1.
в) протонирование молекулы спирта (метанола)
Катионы, в которых положительный заряд находится на атоме кислорода носят общее название катионов оксония.
Заряд атома кислорода в катионе оксония: ZО = 6 – 2 – 3 = +1.
3. Анион, владеющий НЭП (донор электронов), взаимодействует с нейтральной молекулой, имеющей свободную орбиталь (акцептор электронов). В результате реакции образуется анион, у которого отрицательный заряд формально принадлежит атому-акцептору:
Благодаря образованию координативной связи атом-донор нейтрализует свой заряд, а акцептор заряжается отрицательно. Суммарный заряд не изменяется.
Примеры:
а) взаимодействие фторид-аниона и молекулы фторида бора
Заряд атома бора в анионе (BF4)¯ : ZВ = 3-0-4 = -1.
б) взаимодействие молекулы хлорида алюминия и аниона хлора
Заряд атома алюминия (AlCl4)¯ : ZAl = 3-0-4 = -1.
4. И свободная орбиталь и неподелённая электронная пара принадлежат нейтральным молекулам. Взаимодействие между ними приводит к образованию новой нейтральной молекулы, но атомы, выступающие и в качестве донора, и в качестве акцептора, получают заряды с противоположными знаками:
Ковалентная связь, образование которой сопровождается появлением разноимённых зарядов на соседних атомах, представляет собой сочетание ковалентной и ионной связей и называется семиполярной или полуионной связью (приставка «семи» означает «наполовину»).
Примеры:
а) взаимодействие молекул аммиака и фторида бора
ZN = 5-0-4 = +1, ZB = 3-0-4 = -1.
Если семиполярную связь изображают с помощью стрелки, то заряды на атомах не ставятся, но мы их всегда должны иметь в виду: Н3N → BF3.
б) взаимодействие диметилового эфира (метоксиметана) с фторидом бора
ZO = 6-2-3= +1 ZB = -1.
Важным примером соединения, содержащего семиполярную связь, является азотная кислота. Она образуется при каталитическом взаимодействии азотистой кислоты и атомарного кислорода:
Уравнение реакции (без деталей).
Донором электронной пары является атом азота, акцептором — атом кислорода, который освобождает для этого одну р-орбиталь, спаривая два электрона. Энергия, затраченная на этот процесс компенсируется при образовании новой связи.
Энергия, затраченная на этот процесс компенсируется при образовании новой связи.
Формально атомы кислорода в нитрогруппе имеют разные заряды. Но фактически здесь происходит процесс делокализации электронов, заряды на атомах кислорода выравниваются, каждый атом реально имеет заряд – 0,5. Атом азота сохраняет заряд +1:
Ваша оценка?
Петр Иваныч
Возможно этот человек ответит на ваши вопросы
Задать вопрос
Донорно-акцепторная связь
Home / Учебник ОБЩАЯ ХИМИЯ / Глава 4. Химическая связь / Донорно-акцепторная связь
В процессе образования ковалентной связи связанные электроны проникают во внешнюю оболочку обоих связываемых атомов. Соответственно, количество электронов на внешних оболочках этих атомов увеличивается на один электрон.
Существует и другой механизм образования связи: за счет пары электронов только ОДНОГО из взаимодействующих атомов.
В результате образования молекулы атом Х может дополнить свою оболочку до 8 электронов, однако в образовании связи будут принимать участие не все 8 электронов, а только часть. Электроны, не принимающие участия в образовании химических связей, считаются свободными, несвязанными.
Атом
Атомы со свободными (несвязанными) электронами являются донорами электронов при образовании донорно-акцепторной химической связи. Их партнерами, в первую очередь, становятся это те атомы, чьи оболочки содержат менее 8 электронов. Это атомы в молекулах, образованных элементами 2-го и 3-го периодов (с числом электронов во внешнем слое менее 4).
Атомы натрия (Na), магния (Mg) и алюминия (Al) после образования максимального числа ковалентных связей, к примеру, после образования молекул NaF, MgF2, AlF3 содержат соответственно 2, 4 и 6 электронов во внешней оболочке. Внешние оболочки атомов Na, Mg и Al имеют менее 8 электронов, т.е. остаются ненасыщенными.
Атомы азота (N), кислорода (O) и фтора (F) в соединениях аммоний (NH3), вода (H2O) и фторид водорода (HF) содержат соответственно 2, 4 и 6 электронов во внешних оболочках, которые не принимают участия в образовании химических связей, т.е. их считают свободными. Поскольку в образованных соединениях NH3, H2O и HF во внешних оболочках атомов N, O и F находится 8 электронов, свободные, несвязанные электроны не могут участвовать в образовании ковалентной связи из-за того, что внешняя оболочка этих атомов насыщена электронами.
Хорошо известны следующие устойчивые соединения:
H3B ← NH3; H3B ← N(CH3)2; F3B ←NH3; F3B ←O(CH3)2; Cl2Be ←O(C2H5)2; Cl3Al ←NH3; и др.
Стрелочки (←) здесь обозначают связи донор-акцептор.
Доноры (атомы N и O) в этих примерах отдают 2 электрона. Акцепторами являются B, Be и Al.
При образовании донорно-акцепторной связи атомы-акцепторы увеличивают число электронов в своих внешних оболочках на 2.
По правилам образования донорно-акцепторной связей, инертные газы могут образовывать Д-А связи как доноры пар электронов с атомами, имеющими 6 электронов на внешней оболочке, и синтез XeO, XeO2 и XeO3 является опытным подтверждением этого положения.
Не только нейтральные атомы и молекулы могут играть роль доноров электронов и акцепторов, но и положительно и отрицательно заряженные атомы и молекулы, т.е. катионы и анионы.
Так, например, аммиак (NH3) и катион водорода (H+) образуют катион (NH4+), где один атом связан с азотом за счет электронов азота. Анион (Cl—) является донором пары электронов в ионах (ClO) —.
Энергия связи между Al и N в соединении Cl3Al←NH3 составляет 165 кДж/моль; в то время как энергия ковалентной связи между Al и N равняется около 400 кДж/моль.
Молекула NaCl образована из атомов натрия и хлора. У хлора 8 электронов во внешней оболочке, тогда так у натрия — только 2. То есть, внешняя оболочка натрия не заполнена. С другой стороны, только 2 электрона из заполненной оболочки хлора принимают участие в образовании гетерополярной связи Na-Cl.
Молекула Na2Cl2 была получена экспериментальным путем, и измерена энергия ее образования 2NaCl → Na2Cl2 . Эта энергия равняется 186 кДж/моль (одна донорно-акцепторная связь равна 93 кДж/моль). Энергия связи мономера NaCl равняется 410 кДж/моль, тогда так энергии связей Na — Na и Cl — Cl составляют, соответственно, 75 кДж/моль и 238 кДж/моль, т.е. донорно-акцепторная связь намного слабее, чем ковалентная связь. Как правило, энергия донорно-акцепторной связи равна ½ энергии ковалентной связи.
Одной из главных причин сравнительно слабой донорно-акцепторной связи, является следующее. При вычислении энергии связи энергия электронов исходных атомов, принимающих участие в формировании связи, вычитается из вычисленной энергии молекулы. Энергия ионизации двух несвязанных электронов хлора в NaCl превышает сумму ПЭИ обоих атомов: натрия и хлора.
При вычислении энергии связи энергия электронов исходных атомов, принимающих участие в формировании связи, вычитается из вычисленной энергии молекулы. Энергия ионизации двух несвязанных электронов хлора в NaCl превышает сумму ПЭИ обоих атомов: натрия и хлора.
Энергия электронов в атомах, связанных посредством химических донорно-акцепторных связей, меньше, чем энергия этих электронов в разделенных атомах. Выигрыша в энергии при образовании связи по этой составляющей нет.
Принципы образования связи в многоэлектронных атомах >>
Потенциал ионизации и энергия связи в двухатомных молекулах >>
Энергия связи >>
Длина связи >>
G-теория химической связи >>
Правило валентности >>
Донорно-акцепторная связь
Ван-дер-ваальсовая связь >>
Изомеризация. Динамическая связь >>
Динамическая связь >>
Основы стереохимии >>
Дополнительный светопоглощающий компонент сделал органические солнечные батареи более эффективными и долговечными
9 сентября 2022, 21:00
Альтернативная энергетика
Органическая химия
Фотоника
Химия полимеров
Российские ученые вместе с китайскими коллегами разработали высокоэффективные органические солнечные батареи. Они оказались эффективнее и устойчивее к нагреванию и освещению благодаря добавлению к стандартной смеси «донор + акцептор» третьего компонента, поглощающего свет в промежуточном диапазоне между ними. Результаты работы, поддержанной грантом Российского научного фонда (РНФ) и опубликованной в Journal of Materials Chemistry A, помогут приблизить время, когда гибкие, легкие и экологичные органические солнечные батареи получат широкое распространение в быту и промышленности.
Энергетика остается одним из основных источников выбросов углерода, которые страны всего мира стараются сокращать. Один из путей — использование альтернативных способов получения электричества, например, преобразование в него солнечного света.
Один из путей — использование альтернативных способов получения электричества, например, преобразование в него солнечного света.
В основе фотовольтаических устройств, способных на это, лежит фотоэффект, когда под действием квантов света (фотонов) электроны вырываются из одного органического полупроводника (донора) и переходят в другой (акцептор). В месте их ухода остаются положительные заряды — «дырки», которые при включении такого фотоэлемента в электрическую цепь движутся к положительному электроду (аноду), а электроны — к отрицательному электроду (катоду), в результате чего возникает электрический ток.
«Это обычное устройство органических солнечных батарей — легких, компактных, гибких, прочных и потенциально полупрозрачных систем. Однако сейчас есть ряд проблем, ограничивающих широкое применение таких устройств. Например, в процессе работы они поглощают свет в относительно узком спектральном диапазоне, велики потери энергии при передаче зарядов между их компонентами, и при этом солнечный элемент недостаточно стабилен, особенно при неизбежном нагревании», — рассказывает руководитель проекта, поддержанного грантом РНФ, Сергей Пономаренко, доктор химических наук, заведующий лабораторией функциональных материалов для органической электроники и фотоники, директор Института синтетических полимерных материалов имени Н.
Сотрудники ИСПМ РАН (Москва) совместно с китайскими коллегами из Уханьского университета решили эту проблему и создали высокоэффективные органические солнечные батареи на основе тройных смесей органических полупроводников. Они разработали и добавили еще один компонент — сложную органическую молекулу, которую можно достаточно просто синтезировать. Она поглощает солнечный свет в промежуточном диапазоне спектра между донором и акцептором. В результате фотоэффект запускается во всех трех полупроводниках, но носителям заряда проще мигрировать: дополнительный компонент служит мостиком, «перейти» по которому электронам проще, чем перепрыгнуть с одного «берега» (донора) на другой (акцептор). Потери энергии, соответственно, снижаются, и в итоге удалось повысить эффективность преобразования солнечного света до 18% (в сравнении с исходными 16%), что соответствует мировому уровню для данного типа устройств.
Кроме того, добавка улучшила структуру органических солнечных элементов, сделав ее более устойчивой к нагреванию и воздействию света.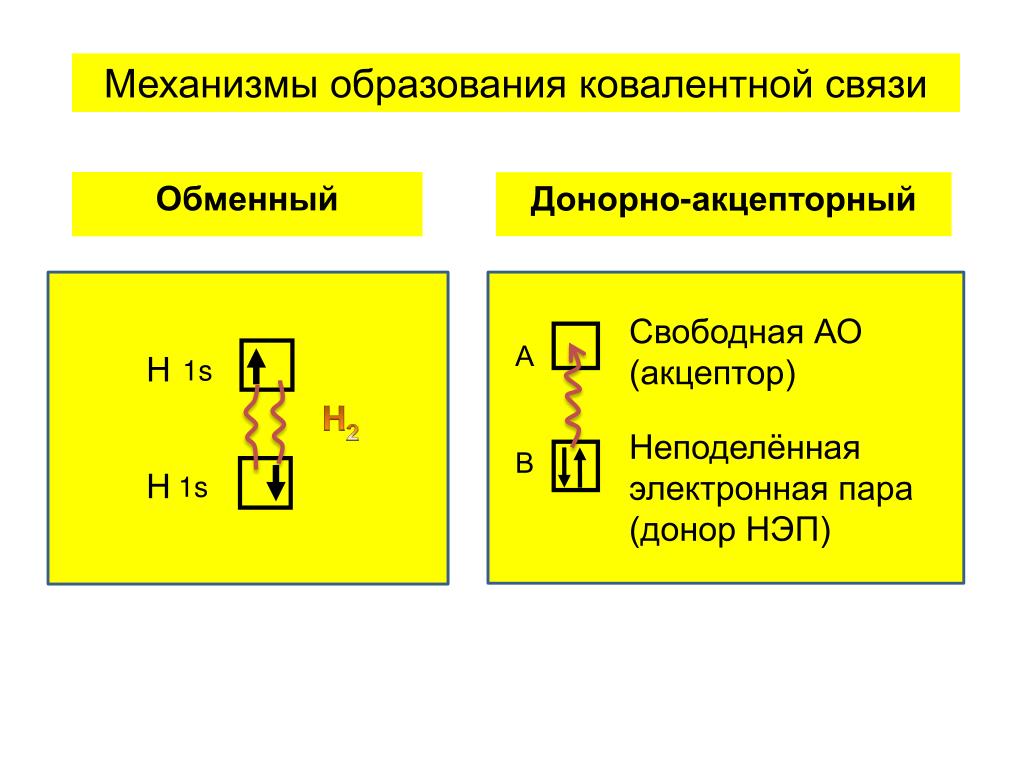 Малая стабильность обычных органических солнечных батарей обусловлена достаточно слабыми межмолекулярными связями. Вещество за счет специфических боковых групп, активно взаимодействующих с исходными донором и акцептором, послужило своего рода легирующей добавкой — совсем как примеси в сплаве, улучшающие его свойства. Фотоэлемент стал более устойчивым к нагреванию: критический фазовый переход, при котором устройство теряет свою активность, начинался не при 100°C, а при 110°C. При моделировании обычной рабочей температуры в 85°C авторы выяснили, что у модифицированной системы спустя 1000 часов эффективность преобразования солнечной энергии в электричество снизилась до 86% от изначальной, тогда как у исходной — до 67%. Аналогичный результат исследователи получили, освещая образцы светом, по спектру схожим с солнечным: спустя то же время эффективность трехкомпонентного материала упала до 75%, двухкомпонентного — до 60%.
Малая стабильность обычных органических солнечных батарей обусловлена достаточно слабыми межмолекулярными связями. Вещество за счет специфических боковых групп, активно взаимодействующих с исходными донором и акцептором, послужило своего рода легирующей добавкой — совсем как примеси в сплаве, улучшающие его свойства. Фотоэлемент стал более устойчивым к нагреванию: критический фазовый переход, при котором устройство теряет свою активность, начинался не при 100°C, а при 110°C. При моделировании обычной рабочей температуры в 85°C авторы выяснили, что у модифицированной системы спустя 1000 часов эффективность преобразования солнечной энергии в электричество снизилась до 86% от изначальной, тогда как у исходной — до 67%. Аналогичный результат исследователи получили, освещая образцы светом, по спектру схожим с солнечным: спустя то же время эффективность трехкомпонентного материала упала до 75%, двухкомпонентного — до 60%.
«Органические солнечные батареи являются легкими, гибкими и безопасными для окружающей среды как в процессе эксплуатации, так и после их утилизации. Создание их стабильных и эффективных моделей и прототипов приближает перспективу широкого использования подобных устройств в различных областях: фотовольтаике, интегрированной в здания на крышах, стенах и окнах, в автомобилях, авиационной и космической технике, а также для зарядки различных портативных устройств в полевых условиях», — подводит итог Сергей Пономаренко.
Создание их стабильных и эффективных моделей и прототипов приближает перспективу широкого использования подобных устройств в различных областях: фотовольтаике, интегрированной в здания на крышах, стенах и окнах, в автомобилях, авиационной и космической технике, а также для зарядки различных портативных устройств в полевых условиях», — подводит итог Сергей Пономаренко.
Источник: Пресс-служба РНФ
Публикации из новости
По дате
По цитируемости
High-performance ternary solar cells by introducing a medium bandgap acceptor with complementary absorption, reducing energy disorder and enhancing glass transition temperature
Wan J. , Dyadishchev I., Sun R., Wu Q., Wu Y., Zhang M., Peregudova S., Ponomarenko S., Luponosov Y., Min J.
, Dyadishchev I., Sun R., Wu Q., Wu Y., Zhang M., Peregudova S., Ponomarenko S., Luponosov Y., Min J.
Q1 Journal of Materials Chemistry A, 2022, цитирований: 0
Поделиться
Свежее
Читайте также
Химические связи, подготовка к ЕГЭ по химии
Химическая связь — связь между атомами в молекуле или молекулярном соединении, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Ковалентная связь ( лат. со — совместно + valens — имеющий силу)
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Если атомы, образующие ковалентную связь, имеют одинаковые значения электроотрицательности, то связь между ними называется ковалентной неполярной
связью. В таких молекулах нет «полюса» — электронная плотность распределяется равномерно. Примеры: Cl2, O2, H2,
N2, I2.
Если атомы, образующие ковалентную связь, имеют разные значения электроотрицательности, то связь между ними называется ковалентной полярной. В таких молекулах имеется «полюс» — электронная плотность смещена к более электроотрицательному элементу. Примеры: HCl, HBr, HI, NH3, H2O.
Ковалентная связь может быть образована по обменному механизму — обобществлению электронной пары. В таком случае каждый атом «одинаково» вкладывается создание связи. Например, два атома азота, образующие молекулу N2, отдают по 3 электрона с внешнего уровня для создания связи.
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной
электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.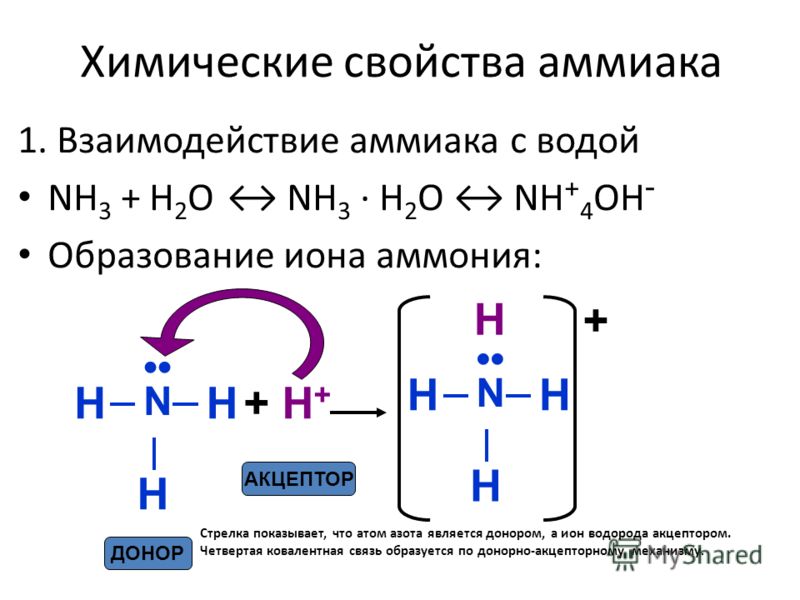
Рекомендую выучить список веществ, образованных по донорно-акцепторному механизму:
- NH4+ — в ионе аммония
- NH4+Cl, NH4+Br — внутри иона аммония во всех его солях
- NO3— — в нитрат ионе
- KNO3, LiNO3 — внутри нитрат иона во всех нитратах
- O3 — озон
- H3O+ — ион гидроксония
- CO — угарный газ
- K[Al(OH)4], Na2[Zn(OH)4] — во всех комплексных солях есть хотя бы одна ковалентная связь, возникшая по донорно-акцепторному механизму
Ионная связь
Ионная связь — один из видов химической связи, в основе которого лежит электростатическое взаимодействие между
противоположно заряженными ионами.
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
NaF, CaCl2, MgF2, Li2S, BaO, RbI.
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
Металлическая связь — вид химической связи удерживающая вместе атомы металла. Этот тип связи выделен отдельно, так как его отличием является
наличие высокой концентрации в металлах электронов проводимости — «электронного газа». По природе металлическая связь близка к ковалентной.
Этот тип связи выделен отдельно, так как его отличием является
наличие высокой концентрации в металлах электронов проводимости — «электронного газа». По природе металлическая связь близка к ковалентной.
«Облако» электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.
Водородная связь
Водородная связь — вид химической связи, образующийся между некоторыми молекулами, содержащими водород. Одна из наиболее частых ошибок считать, что в самом газе, водороде, имеются водородные связи — это вовсе не так.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Необходимо осознать самую важную деталь: водородные связи образуются между молекулами, а не внутри.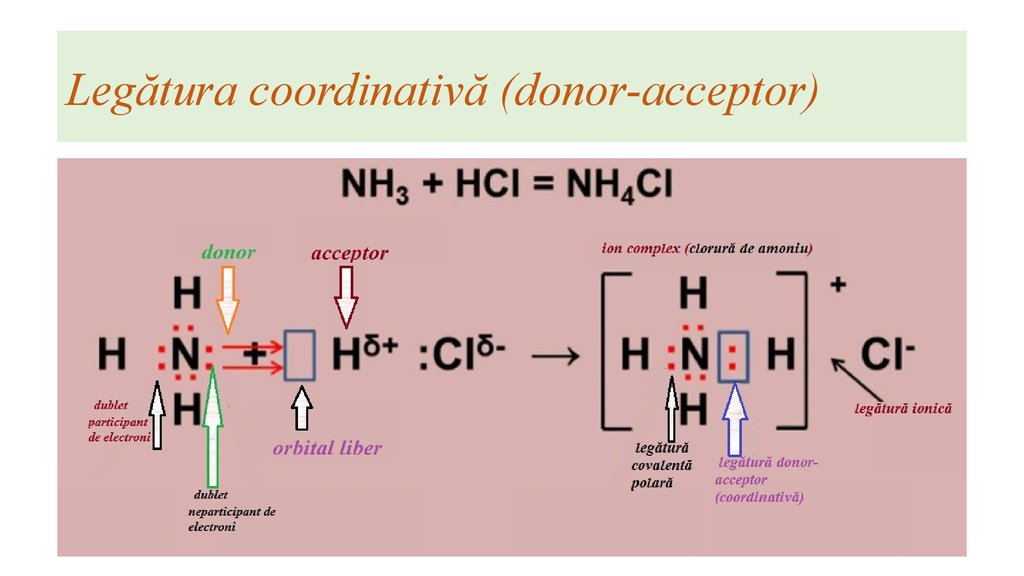 Они имеются между молекулами:
Они имеются между молекулами:
- H2O
- NH3
- HF
- Органических спиртов: С2H5OH, C3H7OH
- Органических кислот: CH3COOH, C2H5COOH
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Готовимся к углубленному изучению химии : 3.9 Донорно-акцепторный механизм образования
3.9. Донорно-акцепторный механизм образования ковалентной связи. Ионная, металлическая, водородная связи. Межмолекулярные взаимодействия. Типы кристаллических решеток
Донорно-акцепторный механизм образования связи
Существует еще один механизм образования связи. Рассмотрим его на примере взаимодействия молекулы аммиака с молекулой трифторида бора:
У атома азота в молекуле аммиака после образования связей с атомами
водорода остается еще одна валентная орбиталь с неподеленной парой электронов
(в структурной формуле обозначена точками). У атома бора в молекуле трифторида
бора после образования связей с атомами фтора остается одна свободная валентная
орбиталь (в структурной формуле обозначена • ). Неподеленную пару валентных
электронов атом азота может предоставить атому бора » в совместное
использование» , » поделиться» с ним этой электронной парой. При
этом электроны бывшей неподеленной пары становятся общими для атомов азота и
бора, то есть между ними образуется ковалентная связь. Но при этом у атомов
бора и азота возникают еще и формальные заряды: – 1 е у атома бора и +1 е у
атома азота:
Неподеленную пару валентных
электронов атом азота может предоставить атому бора » в совместное
использование» , » поделиться» с ним этой электронной парой. При
этом электроны бывшей неподеленной пары становятся общими для атомов азота и
бора, то есть между ними образуется ковалентная связь. Но при этом у атомов
бора и азота возникают еще и формальные заряды: – 1 е у атома бора и +1 е у
атома азота:
В результате между атомами азота и бора возникает и ковалентная, и ионная связь. При этом атом азота является донором электронной пары (» дает» ее для образования связи), а атом бора – акцептором (» принимает» ее при образовании связи). Отсюда и название механизма образования такой связи – » донорно-акцепторный» .
Донорно-акцепторный механизм образования связи – механизм образования
связи, при котором один из связываемых атомов является донором электронной
пары, а другой – акцептором. |
При образовании связи по донорно-акцепторному механизму образуются
одновременно и ковалентная связь, и ионная.
Конечно, после образования связи за счет разницы в электроотрицательности
связываемых атомов происходит поляризация связи, возникают частичные заряды,
снижающие эффективные (реальные) заряды атомов.
Рассмотрим другие примеры.
Если рядом с молекулой аммиака окажется сильно полярная молекула хлороводорода, в которой на атоме водорода имеется значительный частичный заряд
, то в этом случае роль акцептора электронной пары будет выполнять атом водорода. Его 1s-АО хоть и не совсем пустая, как у атома бора в предыдущем примере, но электронная плотность в облаке этой орбитали существенно понижена.
Пространственное
строение получившегося катиона, иона аммония NH4,
подобно строению молекулы метана, то есть все четыре связи N—H совершенно
одинаковы.
Образование ионных кристаллов хлорида аммония NH4Cl можно наблюдать,
смешав газообразный аммиак с газообразным хлороводородом:
NH3(г)+ HCl(г) = NH4Cl(кр)
Донором электронной пары может быть не только атом азота. Им может быть, например, атом кислорода молекулы воды. С тем же хлороводородом молекула воды будет взаимодействовать следующим образом:
Образующийся
катион H3O называется ионом оксония и, как вы скоро узнаете, имеет огромное значение в
химии.
В заключение рассмотрим электронное строение молекулы угарного газа (монооксида
углерода) СО:
В ней, кроме трех
ковалентных связей (тройной связи), есть еще и ионная связь.
Условия образования связи по донорно-акцепторному механизму:
1) наличие у одного из атомов неподеленной пары валентных электронов;
2) наличие у другого атома свободной орбитали на валентном подуровне.
Донорно-акцепторный механизм образования связи распространен довольно широко.
Особенно часто он встречается при образовании соединений d-элементов. Атомы почти
всех d-элементов имеют много свободных валентных
орбиталей. Поэтому они являются активными акцепторами электронных пар.
ДОНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ ОБРАЗОВАНИЯ СВЯЗИ, ИОН АММОНИЯ, ИОН ОКСОНИЯ, УСЛОВИЯ ОБРАЗОВАНИЯ СВЯЗИ ПО ДОНОРНО-АКЦЕПТОРНОМУ МЕХАНИЗМУ.
·
ОБМЕННЫЙ МЕХАНИЗМ — в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет в общее пользование по одному электрону:
·
ДOНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ — образование связи происходит за счет пары электронов атома-донора и вакантной орбитали атома-акцептора:
Характеристики ковалентной связи не
зависят от механизма ее образования.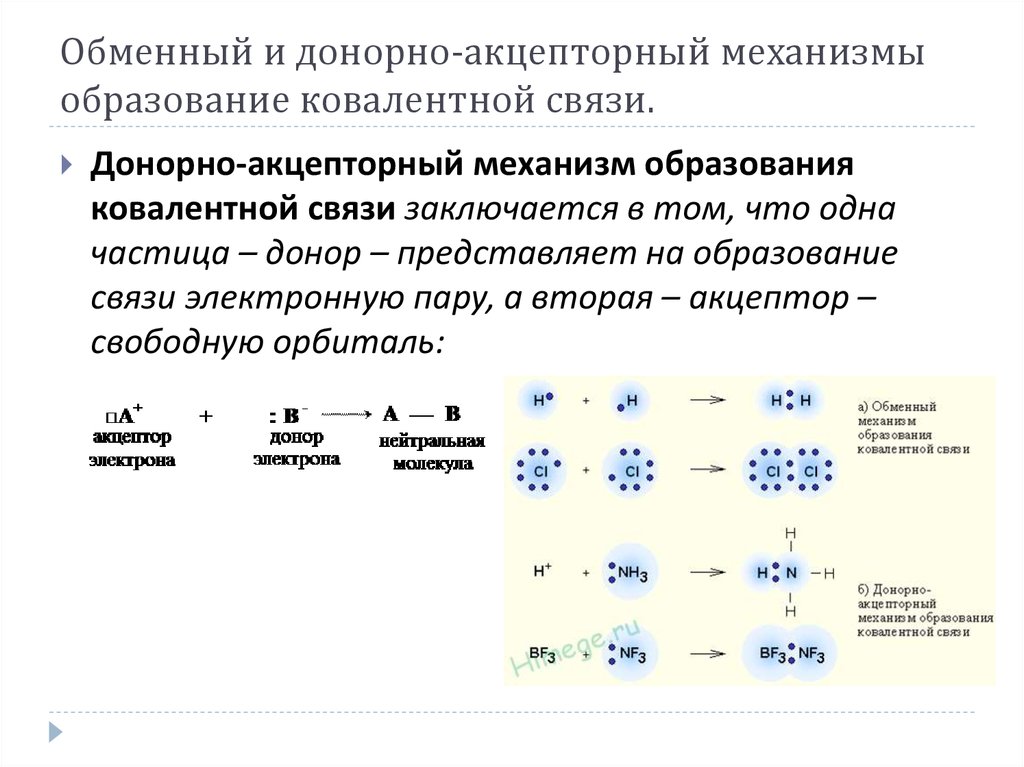
ИОННЫЙ ТИП ХИМИЧЕСКОЙ СВЯЗИ
Чисто ионной связью называется химически связанное состояние атомов, при
котором устойчивое электронное окружение достигается путём полного перехода
общей электронной плотности к атому более электроотрицательного элемента.
На практике полный переход электрона от одного атома к другому атому-паренеру
по связи не реализуется, поскольку каждый элемент имеет большую или меньшую, но
не нулевую, электроотрицательность, илюбая связь будет в некоторой степени
ковалентной.
Ионная связь возможна только между атомами электроположительных и электроотрицательных
элементов, находящихся в состоянии разноименно заряженных ионов.
Ионы — это электрически заряженные частицы, образующиеся из нейтральных
атомов или молекул путем отдачи или присоединени электронов.При отдаче
электронов образуется положительно заряженный ион-катион, при
присоединении-отрицательный-анион.
При отдаче или присоединении электронов молекулами образуются молекулярные или
многоатомные ионы, например О2+ — катион диоксигенила, NO2--нитрит-ион.
Одноатомные катионы и одноатомные анионы возникают при химической реакции между
нейтральнами атомами путем взаимопередачи электронов. При этом атом
электроположительного элемента, обладающий небольшим числом внешних электронов,
переходит в более устойчивое состояние одноатомного катиона путем уменьшения
числа этих электронов. Наоборот, атом электроотрицательного элемента, имеющий
большое число электроно на внешнем слое , переходит в более устойчивое для него
состояние одноатомного иона путем увеличения числа электронов.
Одноатомные катионы образуются, как правило, металлами, а одноатомные
анионы-неметаллами. При передаче электронов металлического и неметаллического
элементов стремятся сформировать вокруг своих ядер устойчивую конфигурацию
электронной оболочки. Атом неметаллического элемента создает внешнюю оболочку
последующего благородного газа, тогда как атом металлического элемента после
отдачи внешних электронов получает устойчивую конфигурацию предыдущего
благородного газа.
Схема образования ионной связи
Кулоновские силы притяжения, возникающие при взаимодействии заряженных ионов, сильные и действуют одинаково во всех направлениях. В результате этого расположение ионов упорядочивается в пространстве определенным образом, образуя ионную кристаллическую решётку. Вещества с ионной КР при обычных условиях находятся в кристаллическом состоянии, они имеют высокие температуры плавления и кипения.
Вещество | |||||
Свойство | |||||
t пл 0С | |||||
t кип 0С |
МЕТАЛЛИЧЕСКИЙ ТИП ХИМИЧЕСКОЙ СВЯЗИ
Металлы и их сплавы кристаллизуются в форме металлических решёток. Узлы в металлической решётке заняты положительными ионами металлов. Валентные
электроны, отделившиеся от атомов металлов и оставшиеся в узлах кристаллической
решётки ионы, более или менее свободно перемещаются в пространстве между
катионами и обуславливают электрическую проводимость металлов. Между ионами и
свободными электронами возникают электростатические взаимодействия, которые и
являются причиной возникновения металлической связи.
Узлы в металлической решётке заняты положительными ионами металлов. Валентные
электроны, отделившиеся от атомов металлов и оставшиеся в узлах кристаллической
решётки ионы, более или менее свободно перемещаются в пространстве между
катионами и обуславливают электрическую проводимость металлов. Между ионами и
свободными электронами возникают электростатические взаимодействия, которые и
являются причиной возникновения металлической связи.
СХЕМА ОБРАЗОВАНИЯ МЕТАЛЛИЧЕСКОЙ СВЯЗИ
Металлическая связь имеет сходство как с ионной (образуется за
счёт взаимодействия между заряженными частицами: электронами и ионами), так и с
ковалентной ( происходит обобществление электронов, но в отличии от ковалентной
связи, где электроны локализованы около определенных атомов, электроны в
металлах обобществляются для всего кристалла). Свободные электроны иногда
называют электронным газом.
Катионы в металлических решётках не обладают поступательным движением, а
совершают колебания вокруг положения узлов решётки. Амплитуда этих колебаний
возрастает при повышении температуры, а при достижении температуры плавления
металла решётка разрушается. Температура плавления металлов, как правило
возрастает с увеличением числа валентных электронов в их атомах.
Амплитуда этих колебаний
возрастает при повышении температуры, а при достижении температуры плавления
металла решётка разрушается. Температура плавления металлов, как правило
возрастает с увеличением числа валентных электронов в их атомах.
ВОДОРОДНЫЙ ТИП ХИМИЧЕСКОЙ СВЯЗИ
ВОДОРОДНАЯ СВЯЗЬ (Н-связь) – особый тип взаимодействия между реакционно-способными группами, при этом одна из групп содержит атом водорода, склонный к такому взаимодействию. Водородная связь – глобальное явление, охватывающее всю химию. В отличие от обычных химических связей, Н-связь появляется не в результате целенаправленного синтеза, а возникает в подходящих условиях сама и проявляется в виде межмолекулярных или внутримолекулярных взаимодействий.
Отличительная черта водородной связи
– сравнительно низкая прочность, ее энергия в 5–10 раз ниже, чем энергия
химической связи. По энергии она занимает промежуточное положение между
химическими связями и Ван-дер-ваальсовыми взаимодействиями, теми, что
удерживают молекулы в твердой или жидкой фазе.
Для возникновения водородных связей важно, чтобы в молекулах вещества были атомы водорода, связанные с небольшими, но электроотрицательными атомами, например: O, N, F. Это создает заметный частичный положительный заряд на атомах водорода. С другой стороны, важно, чтобы у электроотрицательных атомов были неподеленные электронные пары. Когда обедненный электронами атом водорода одной молекулы (акцептор) взаимодействует с неподеленной электронной парой на атоме N, O или F другой молекулы (донор), то возникает связь, похожая на полярную ковалентную.
Водородные связи между молекулами воды (обозначены пунктиром)
Объемная модель, показывающая расположение молекул воды, связанных водородными связями
Учитывая заметную разницу зарядов на
атомах Н и О соседних молекул, дополнительную прочность этой межмолекулярной
связи придает притяжение разноименных зарядов. Водородные связи характерны для
таких веществ, как вода H2O, аммиак NH3, фтороводород HF.
Водородные связи характерны для
таких веществ, как вода H2O, аммиак NH3, фтороводород HF.
В водных растворах аммиака или HF эти молекулы образуют водородные связи не только между собой, но и с молекулами воды. Благодаря водородным связям аммиак NH3 имеет фантастическую растворимость: в 1 л воды может растворяться 750 л газообразного аммиака! В органических веществах встречаются также внутримолекулярные водородные связи, сильно влияющие на пространственную форму этих молекул.
Межмолекулярное взаимодействие
Межмолекулярное взаимодействие — взаимодействие молекул между собой, не приводящее к разрыву или образованию новых химических связей. В их основе, как и в основе химической связи, лежат электрические взаимодействия.
Силы Ван-дер-Ваальса включают все виды межмолекулярного
притяжения и отталкивания. Они получили название в честь Я.Д. Ван-дер-Ваальса, который первым принял во внимание межмолекулярные взаимодействия для объяснения свойств реальных газов
и жидкостей. Эти силы определяют отличие реальных газов от идеальных,
существование жидкостей и молекулярных кристаллов. От них зависят многие
структурные, спектральные и другие свойства веществ.
Они получили название в честь Я.Д. Ван-дер-Ваальса, который первым принял во внимание межмолекулярные взаимодействия для объяснения свойств реальных газов
и жидкостей. Эти силы определяют отличие реальных газов от идеальных,
существование жидкостей и молекулярных кристаллов. От них зависят многие
структурные, спектральные и другие свойства веществ.
Основу ван-дер-ваальсовых сил составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой. На определенном расстоянии между молекулами силы притяжения и отталкивания уравновешивают друг друга, и образуется устойчивая система.
Ван-дер-ваальсовы силы заметно уступают химическому связыванию.
Например, силы, удерживающие атомы хлора в молекуле хлора почти в десять раз
больше, чем силы, связывающие молекулы Cl2 между собой. Но без этого слабого
межмолекулярного притяжения нельзя получить жидкий и твердый хлор.
Ориентационное взаимодействие
Полярные молекулы, в которых центры тяжести положительного и отрицательного зарядов не совпадают, например HCl, H2O, NH3, ориентируются таким образом, чтобы рядом находились концы с противоположными зарядами. Между ними возникает притяжение.
Для взаимодействия двух диполей энергия притяжения между ними (энергия Кеезома) выражается соотношением:
EК = −2 μ1 μ2 / 4π ε0 r3,
где μ1 и
μ2 — дипольные моменты
взаимодействующих диполей, r — расстояние между ними. Притяжение
диполь-диполь может осуществляться только тогда, когда энергия притяжения
превышает тепловую энергию молекул; обычно это имеет место в твердых и жидких
веществах. Диполь-дипольное взаимодействие проявляется в полярных жидкостях
(вода, фтороводород).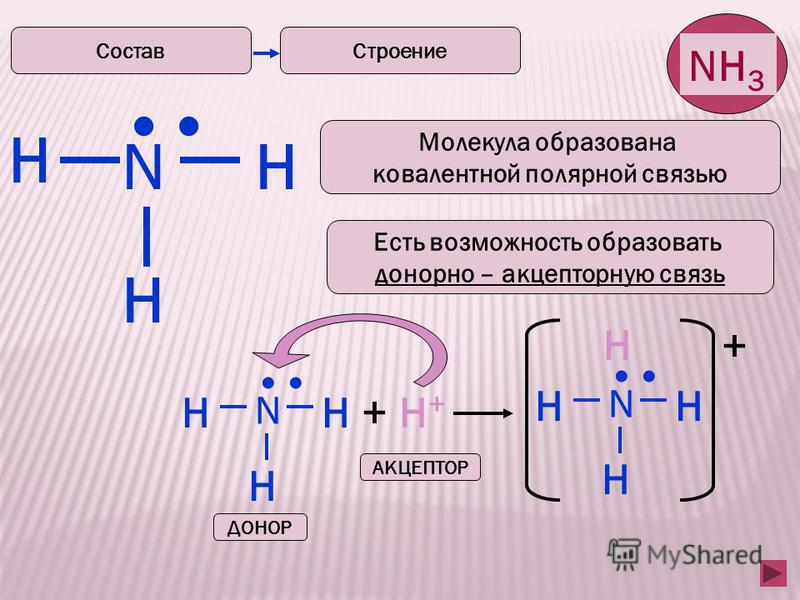
Индукционное взаимодействие
Если рядом с полярная молекула окажется полярная рядом с неполярными, она начнет влиять на них. Поляризация нейтральной частицы под действием внешнего поля (наведение диполя) происходит благодаря наличию у молекул свойства поляризуемости γ. Постоянный диполь может индуцировать дипольное распределение зарядов в неполярной молекуле. Под действием заряженных концов полярной молекулы электронные облака неполярных молекул смещаются в сторону положительного заряда и подальше от отрицательного. Неполярная молекула становится полярной, и молекулы начинают притягиваться друг к другу, только намного слабее, чем две полярные молекулы.
Энергия притяжения между постоянным и наведенным диполем (энергия Дебая) определяется выражением:
EД = −2 μнав2 γ / r6,
где μнав —
момент наведенного диполя.
Притяжение постоянного и наведенного диполей обычно очень слабое, поскольку поляризуемость молекул большинства веществ невелика. Оно действует только на очень малых расстояниях между диполями. Этот вид взаимодействия проявляется главным образом в растворах полярных соединений в неполярных растворителях.
Дисперсионное взаимодействие
Между неполярными молекулами также может возникнуть притяжение. Электроны, которые находятся в постоянном движении, на миг могут оказаться окажется сосредоточенными с одной стороны молекулы, то есть неполярная частица станет полярной. Это вызывает перераспределение зарядов в соседних молекулах, и между ними устанавливаются кратковременные связи:
Энергия такого взаимодействия (энергия Лондона) дается соотношением:
EЛ = −2 μмгн2 γ2 / r6,
где μмгн —
момент мгновенного диполя. Лондоновские силы притяжения между неполярными
частицами (атомами, молекулами) являются весьма короткодействующими. Значения
энергии такого притяжения зависят размеров частиц и числа электронов в
наведенных диполях. Эти связи очень слабые — самые слабые из всех межмолекулярных
взаимодействий. Однако они являются наиболее универсальными, так как возникают
между любыми молекулами.
Лондоновские силы притяжения между неполярными
частицами (атомами, молекулами) являются весьма короткодействующими. Значения
энергии такого притяжения зависят размеров частиц и числа электронов в
наведенных диполях. Эти связи очень слабые — самые слабые из всех межмолекулярных
взаимодействий. Однако они являются наиболее универсальными, так как возникают
между любыми молекулами.
КРИСТАЛЛИЧЕСКИЕ РЕШЁТКИ
Из курса физики вы знаете, что вещества могут существовать в трёх агрегатных состояниях:твёрдм, жидком, газообразном. В данном параграфе рассмотрим кристаллические вещества, т.е. вещества, находящиеся в твёрдом состоянии.
Они образуют кристаллические
решётки.
Кристаллические решётки веществ-это упорядоченное расположение
частиц(атомов, молекул, ионов) в строго определённых точках пространства. Точки
размещния частиц называют узлами кристаллической решётки.
В зависимости от типа частиц, расположенных в узлах кристаллической решётки,
ихарактера связи между ними различают 4 типа кристаллических решёток: ионные,
атомные, молекулярные, металлические. Рассмотрим каждую из решёток в
отдельности и поподробней.
ИОННЫЕ |
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью. Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов. |
Рассмотрим строение кристалла поваренной соли, в узлах которого находятся ионы хлора и натрия. Связи между ионами в кристалле очень прочные и устойчивые.Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи. |
АТОМНЫЕ |
Атомными называют
кристаллические решётки, в узлах которых находятся отдельные атомы, которые
соединены очень прочными ковалентными связями. |
В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры плавления, обладают повышенной твёрдостью. Алмаз-самый твёрдый природный материал. |
МОЛЕКУЛЯРНЫЕ |
Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них ковалентные, как полярные, так и неполярные. Связи в молекулах прочные, но между молекулами связи не прочные. Ниже представлена кристаллическая решётка I2 |
Вещества с МКР имеют малую твёрдость, плавятся при низкой температуре, летучие, при обычных условиях находятся в газообразном или жидком состоянии |
МЕТАЛЛИЧЕСКИЕ |
Металлическими
называют решётки, в узлах которых находятся атомы и ионы металла. |
Для металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность. Типы кристаллических решеток твердых веществ |
УПРАЖНЕНИЯ
1.
Металлическая связь имеет черты сходства с ковалентной связью. Сравните эти химические связи между собой.
Решение: Образование металлической связи происходит благодаря образованию общего электронного облака кристалла металла. Образование ковалентной связи* также происходит за счет обобществления электронов, только не всех, а отдельных, неспаренных. При этом образуются общие электронные пары.
_____________________________________________________________
2.
По формулам веществ определите тип химической связи в них: Ва, ВаВг2, НВг, Вг2.
Решение: Ва — металл, связь металлическая
ВаВr2 — соль, связь ионная (образована металлом и неметаллом)
НВr — газ, вещество молекулярного строения, связь ковалентная полярная (образована двумя разными неметаллами)
Вr2 — жидкость, вещество молекулярного строения, связь ковалентная неполярная (образована двумя одинаковыми атомами атомами неметалла).
_____________________________________________________________
3.
Из приведенных ниже веществ атомную кристалличекую решетку имеет:
1. Магний
Магний
2. Сера
3. Нафталин
4. Алмаз
Решение: Магний – это металл. Он имеет металлическую кристаллическую решетку. Сера, нафталин – молекулярную кристаллическую решетку.
Правильный ответ 4.
_____________________________________________________________
4.
В узлах кристаллических решеток веществ молекулярного строения находятся:
1. Молекулы
2. Атомы
3. Атомы и ионы
4. Молекулы и ионы
Решение: В узлах
кристаллических решеток веществ молекулярного строения находятся
молекулы.
Правильный ответ 1.
_____________________________________________________________
5. Кристаллическая решетка графита:
1. атомная
2. молекулярная
3. ионная
4. металлическая
Решение: Графит образован углеродом – неметаллом. Значит, кристаллическая решетка не может быть ионной, металлической или молекулярной.
Правильный ответ 1.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
Составьте уравнения реакций и схемы образования
а) бромида аммония NH4Br из аммиака и бромоводорода;
б) сульфата аммония (NH4)2SO4 из аммиака и серной кислоты.
2.
Напишите молекулярные формулы следующих соединений:
3.
Какое из двух соединений ковалентное, а какое — полярное ковалентное: F-F, Cl-F ?
4.
Какова прочность связи между частицами кристаллов в молекулярной, ионной, атомной и металлической кристаллических решетках.
5.
Назовите известные вам виды межмолекулярного взаимодействия.
6.
Какие частицы находятся в узлах молекулярной, ионной, атомной и металлической кристаллических решеток.
7.
Приведите примеры
веществ, которые в твердом состоянии имеют молекулярную, ионную, атомную и
металлическую кристаллические решетки.
8.
Какие их следующих веществ являются ионными соединениями:
Почему? Напишите схемы образования этих соединений.
9.
Отличаются ли свойства донорно-акцепторной связи от свойств обычной ковалентной связи.
10.
1. Какие связи присутствуют в NH4Cl: | |
а) ковалентные неполярные | б) водородные |
в) ковалентные полярные | г) металлические |
2. Какая связь возникает при взаимодействии между собой атомов элементов с конфигурацией валентных электронов …3d54s2 и 3d64s2: | |
а) ионная | б) ковалентная полярная |
в) водородная | г) металлическая |
3. Вещества с какими типами химических связей могут образовывать молекулярную кристаллическую решетку: | |
а) ковалентной полярной | б) ионной |
в) водородной | г) металлической |
4. Укажите формулы веществ с ионной связью: | |
а) КОН | б) все ответы верны |
в) К2SO4 | г) KF |
5. В каком ряду названы вещества с атомной, молекулярной и ионной кристаллическими решетками в твердом состоянии: | |
а) алмаз, хлорид натрия, графит | б) белый фосфор, вода, водород |
в) оксид кремния (IV), медь, азот | г) алмаз, фтор, фторид калия |
6. Укажите формулы молекул или ионов, в которых присутствуют ковалентные связи, образованные по донорно-акцепторному механизму: | |
а) СО | б) все ответы верны |
в) NH4 + | г) H3O+ |
7. Охарактеризуйте свойства вещества с молекулярной кристаллической решеткой: | |
а) легкоплавкое | б) растворимое |
в) хорошо проводит электрический ток | г) тугоплавкое |
8. Охарактеризуйте строение иона аммония и химические связи в нем: | |
а) валентность атома азота равна IV | б) степень окисления атома азота равна -3 |
в) все ответы верны | г) все связи ковалентные полярные |
9. Между элементами с атомными номерами 3 и 9 возникает связь: | |
а) ковалентная | б) ионная |
в) металлическая | г) водородная |
10. Сколько валентных электронов атомов азота и водорода в сумме участвуют в образовании химической связи в молекуле аммиака: | |
а) 10 | б) 6 |
в) 7 | г) 3 |
Ответы:
1 | в |
2 | г |
3 | а |
4 | б |
5 | г |
6 | б |
7 | а |
8 | в |
9 | б |
10 | б |
2.
 2.4. Донорно-акцепторный механизм образования ковалентной связи
2.4. Донорно-акцепторный механизм образования ковалентной связиПример. Ион [PtCl6]-2 представляет собой плоский квадрат, в центре которого находится ион Pt+4, в вершинах квадрата четыре иона Cl-, над и под плоскостью квадрата располагаются еще два иона Cl- (октаэдр, в вершинах которого располагаются ионы хлора, а в центре ион платины). Расстояние между ионом платины и всеми ионами хлора одинаково. Валентные углы равны 90о (рис. 2.15).
z
y
x
Рис. 2.15. Схема ориентации в пространствешести d 2sp3-гибридных орбиталей
Единичная ковалентная связь между атомами может возникнуть не только в результате образования пары электронов из двух неспаренных электронов, принадлежащих обоим атомам. Образование обобществленной пары электронов может происходить и в том случае, когда оба атома не имеют неспаренных электронов, но один из них имеет неподеленную пару электронов (донор), а другой свободную орбиталь (акцептор). Первый атом предоставляет для образования связи свою неподеленную пару, он называется донором, а второй предоставляет свободную орбиталь, принимая (акцептируя) на нее эту неподеленную пару, он называется акцептором. Причем образующаяся связь не будет ничем отличаться от других ковалентных связей. Часто говорят об образовании донорно-акцепторной (координационной) химической связи, но при этом надо помнить, что она не является особым типом химической связи, а название указывает только на механизм образования.
Причем образующаяся связь не будет ничем отличаться от других ковалентных связей. Часто говорят об образовании донорно-акцепторной (координационной) химической связи, но при этом надо помнить, что она не является особым типом химической связи, а название указывает только на механизм образования.
Пример. Молекула оксида углерода (CO). По методу ВС атом кислорода может образовывать двойную связь, поскольку имеет только два неспаренных электрона. Эксперимент показывает, что энергия связи в молекуле CO существенно больше и по величине соответствует тройной связи. Образование третьей связи может происходить по донорно-акцепторному механизму. Перекрывание px-орбиталей атомов углерода и кислорода приводит к образованию σ-связи. Неспаренные py электроны углерода и кислорода образуют π-связь. Свободная pz-орбиталь углерода и неподеленная пара электронов кислорода на pz-орбитали образуют вторую
π-связь (рис. 2.16).
65
C | 2s2 | 2px1 | 2py1 | 2pz0 |
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O | 2s2 | 2px1 | 2py1 | 2pz2 |
|
|
|
| |
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
σ−связь π−связь π−связь
Рис. 2.16. Схема образования ковалентной связи в молекулеСО
2.16. Схема образования ковалентной связи в молекулеСО
Донорно-акцепторный механизм объясняет образование ковалентной химической связи между молекулами и ионами, которые в обычном смысле не имеют валентных электронов и не могут образовывать химическую связь, например, в комплексных соединениях. Комплексные соединения (координационные соединения) – химические соединения, в молекулах которых можно выделить центральный атом (комплексообразователь) и непосредственно связанные с ним молекулы или ионы (лиганды). Центральный атом и лиганды образуют внутреннюю сферу, внешнюю сферу составляют, как правило, ионы, компенсирующие заряд внутренней сферы. Например, [h4O]Cl, [Nh5]OH, K[BF4], [Cu(Nh4)4]Cl и т.д. Цен-
тральный атом связан с лигандами ковалентной связью, образованной по донорно-акцепторному механизму. Причем центральный атом может быть как донором, так и акцептором.
Комплексный ион пишется в квадратных скобках, участвует в обменных химических реакциях как единая частица. Заряд комплексного иона определяется алгебраической суммой зарядов центрального атома и лигандов. Число лигандов – координационное число центрального атома.
Заряд комплексного иона определяется алгебраической суммой зарядов центрального атома и лигандов. Число лигандов – координационное число центрального атома.
Пример. Ион [Nh5]+ Nh4 + H+ → [Nh5]+
Атом азота в молекуле аммиака имеет четыре sp3-гибридные орбитали, три из которых идут на образование связей с тремя атомами водорода, а четвертая занята парой электронов. Ион водорода имеет свободную 1s- орбиталь, на которой и размещается неподеленная пара электронов азота. В результате образуется ион [Nh5]+, который имеет тетраэдрическую конфигурацию и четыре равноценных атома водорода (рис. 2.17).
66
N |
| 2s2 | 2px1 |
| 2py1 |
| 2pz1 | |||
|
|
|
|
|
|
|
|
|
| |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
| 1s1 |
|
|
|
|
|
| |
|
|
|
|
| 1s1 |
|
| 1s1 |
| |
H+ |
| 1s0 |
|
|
|
|
| |||
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ-связь | σ-связь | σ-связь | σ-связь |
Рис. | |||
Ион [BF4]− | BF3 +F− → [BF4] − |
| |
Атом бора в молекуле фторида бора имеет три электрона занимающих sp2-гибридные орбитали, которые использует для образования ковалентной связи с атомами фтора, и одну 2pz-свободную орбиталь. Ион фтора имеет неподеленные пары электронов, одна из которых может расположиться на свободной орбитали бора. Это позволяет изменить гибридизацию атомных орбиталей бора на sp3. Образовавшийся ион имеет
тетраэдрическую | конфигурацию и | четыре равноценных иона фтора | |||||||
(рис. 2.18). |
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
B* |
|
| 2s1 | 2px1 |
| 2py1 | 2pz0 |
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
| 2s2 | 2px2 |
| 2py2 | 2pz1 |
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
− |
| 2s2 | 2px2 |
| 2py2 | 2pz1 |
|
| |
F |
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
Рис. 2.18. Схема образования ковалентной связи в ионе[BF4] −
2.18. Схема образования ковалентной связи в ионе[BF4] −
67
2.2.5.Метод молекулярных орбиталей (МО)
Параллельно с методом ВС для описания ковалентной химической связи был разработан метод молекулярных орбиталей (МО), существенный вклад в создание которого внес Малликен (Mulliken).
В основу этого метода положены следующие основные принципы:
1.Каждый электрон в молекуле движется в результирующем поле всех ядер и остальных электронов. Молекула рассматривается как единая частица. (В методе валентных связей электрон находится в эффективном поле своего ядра, а молекула описывается как система взаимодействующих атомов).
2.Состояние электрона в молекуле описывается волновыми функциями, которым соответствуют молекулярные орбитали, подобно атомным орбиталям. Молекулярные орбитали, в отличие от атомных, многоцентровые, поскольку в молекуле имеется не менее двух ядер. Волновая функция молекулярных орбиталей может быть получена сложением или вычитанием волновых функций атомных орбиталей (линейная комбинация АО).
3.Заполнение электронами молекулярных орбиталей осуществляется на основе тех же принципов, что и при заполнении атомных орбиталей (принцип минимума энергии, принцип Паули, правило Хунда). Совокупность молекулярных орбиталей называется электронной конфигурацией молекулы.
Модельной системой при разработке принципов МО был молекулярный ион водорода h3+, который состоит из двух положительно заряженных ядер и одного электрона. Волновая функция, описывающая состояние электрона в этой системе, может быть представлена как линейная комбинация волновых функций основного состояния атома водорода (1s), то есть результат сложения и вычитания волновых функций атомных орби-
талей: Ψ1 = c1 (ΨA + ΨB ), Ψ2 = с2 (ΨА − ΨВ), ci – нормирующие множители (функции нормируется согласно принципу нормировки).
При образовании молекулы из атомов происходит перекрывание атомных орбиталей. Метод МО следующим образом описывает этот процесс. При сложении атомных волновых функций вероятность нахождения электрона в межъядерной области увеличивается, а при вычитании уменьшается. Волновым функция Ψ1 и Ψ2 соответствуют молекулярные орбитали, схема образования которых показана на рис. 2.19.
Волновым функция Ψ1 и Ψ2 соответствуют молекулярные орбитали, схема образования которых показана на рис. 2.19.
Решение уравнения Шредингера с использованием этих волновых функций позволяет определить энергии электрона в молекулярном ионе водорода Е(Ψ1) и Е(Ψ2), которая меньше или больше на величину ∆Е энергии электрона в изолированных атомах водорода.
68
Атомные орбитали | Молекулярные орбитали |
ΨА(1s) ΨВ(1s)
Ψ2
Ψ1
Атом А Атом В
Рис. 2.19. Схема распределения электронной плотности связывающей иразрыхляющей орбиталей в молекулярном ионеводорода
Молекулярная орбиталь, соответствующая волновой функции Ψ1, получила название связывающей орбитали, а волновой функции Ψ2 – разрыхляющей. Поскольку s-орбитали могут перекрываться только по σ-типу, то их двух 1s атомных орбиталей образуется σ-связывающая (σсв) и σ- разрыхляющая (σр) молекулярные орбитали.
Изменение энергии системы в зависимости от расстояния между ядрами для электрона, находящегося на связывающей и разрыхляющей орбиталях, приведено на рис 2. 20. Нахождение электрона на связывающей орбитали приводит к понижению энергии системы, зависимость имеет минимум, соответствующий энергии связи в молекулярном ионе водорода. Нахождение электрона на разрыхляющей молекулярной орбитали приводит к увеличению энергии системы, и молекулярный ион не образуется. Таким образом, условием образования устойчивой системы является превышение числа электронов на связывающих молекулярных орбиталях над числом электронов на разрыхляющих.
20. Нахождение электрона на связывающей орбитали приводит к понижению энергии системы, зависимость имеет минимум, соответствующий энергии связи в молекулярном ионе водорода. Нахождение электрона на разрыхляющей молекулярной орбитали приводит к увеличению энергии системы, и молекулярный ион не образуется. Таким образом, условием образования устойчивой системы является превышение числа электронов на связывающих молекулярных орбиталях над числом электронов на разрыхляющих.
а) | б) | Энергетическая диаграмма | |||||
∆Ε(r) | ∆Ε | АО | МО | АО | |||
∆Ε2(r) – разрыхляющая |
| ||||||
|
|
| σр |
|
|
| |
r |
| 1s |
|
| 1s | ||
∆Ε1(r) – связывающая |
|
|
|
|
|
|
|
rcв |
|
|
|
|
| σсв | |
Рис. 2.20. Зависимость энергии системы (∆Ε(r)) от межъядерного расстояния (а), энергетическая диаграмма молекулярного иона водорода (б)
2.20. Зависимость энергии системы (∆Ε(r)) от межъядерного расстояния (а), энергетическая диаграмма молекулярного иона водорода (б)
69
Для относительной характеристики прочности (энергии) связи вводится понятие кратность связи (формальный порядок связи). Кратность связи К определяется как разность между числом пар электронов на связывающих (nсв/2) и числом пар электронов на разрыхляющих орбита-
лях (nр/2): K = (nсв − nр) / 2 .
Качественное рассмотрение ковалентной связи между двумя атомами сводится к составлению электронной конфигурации молекулы на основе известных схем энергетических диаграмм. При этом выполняются следующие правила:
1.Выбираются атомные орбитали, принимающие участие в образовании химической связи (валентные орбитали). Ими, как правило, являются орбитали электронов внешнего слоя, которые в значительной степени перекрываются и вносят основной вклад в энергию химической связи. АО внутренних слоев слабо перекрываются, их вклад в энергию связи незначителен, поэтому электронная конфигурация молекулы составляется на основе валентных атомных орбиталей. Для s- и p-элементов валентными орбиталями являются ns- и np-электроны (n – главное квантовое число, равное номеру периода).
Для s- и p-элементов валентными орбиталями являются ns- и np-электроны (n – главное квантовое число, равное номеру периода).
2.Взаимодействующие АО должны иметь одинаковую симметрию относительно линии связи, при этом число образующихся МО равно числу исходных. Как было отмечено, ns-атомные орбитали перекрываются
только по σ-типу, образуя две σ-молекулярные оритали. Поскольку перекрывание np-орбиталей осуществляется как по σ-, так и по π-типу, то образуются две σ- и четыре π-молекулярные орбитали.
3. Хотя точное значение энергий МО необходимо рассчитывать, можно пользоваться известными качественными схемами энергетических диаграмм молекул определенного типа.
Для молекул, состоящих из атомов, имеющих ns-валентные атомные орбитали, схема энергетической диаграммы была приведена на рис. 2.20.
Для молекул, состоящих из атомов, имеющих ns- и np-валентные атомные орбитали, энергетическая диаграмма без учета взаимодействия электронов приведена на рис. 2.21.
Взаимодействие электронов на σ(s) и σ(p) молекулярных орбиталях приводит к изменению относительного положения энергетических уров-
ней МО. На диаграмме σсв(px) и πсв(py), πсв(pz) меняются местами (рис. 2.22). Это взаимодействие учитывается при малом отличии энергии
На диаграмме σсв(px) и πсв(py), πсв(pz) меняются местами (рис. 2.22). Это взаимодействие учитывается при малом отличии энергии
ns- и np-атомных орбиталей, что имеет место для молекул, образованных из атомов второго периода с Z ≤ 7 (от лития до азота).
4. Распределение валентных электронов по молекулярным орбиталям производится в соответствии с принципом минимума энергии, принципом Паули и правиломХунда, какиприраспределенииэлектроновпоатомным орбиталям.
70
АО
∆E
px py pz
s
|
| МО | АО | ||||||||||||||
|
| σр(px) |
|
|
|
|
|
| |||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
π |
|
| y) πр |
|
|
|
|
|
|
|
|
| |||||
р(p | (pz) |
|
|
|
|
|
| ||||||||||
|
|
|
|
|
|
|
|
|
| pz |
|
| py px | ||||
πсв(py) πсв(pz) |
|
|
|
|
|
|
| ||||||||||
|
|
|
|
|
|
|
|
|
| σсв(px) |
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| σр(s) |
|
|
|
|
|
| |
s
σсв(s)
Рис. 2.21. Энергетическая диаграмма молекулярных орбиталей для ns- и np- АО в случае слабого взаимодействия s и p-электронов
2.21. Энергетическая диаграмма молекулярных орбиталей для ns- и np- АО в случае слабого взаимодействия s и p-электронов
|
| АО |
|
|
| МО |
|
|
|
|
| АО | |||||||||
∆E |
|
|
| σр(px) |
|
|
|
|
|
|
| ||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| y) |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
| πр(p | πр(pz) |
|
|
|
|
|
|
|
| ||||
| px py | pz |
|
|
|
| pz py px | ||||||||||||||
|
|
|
|
|
|
|
|
| σсв(px) |
|
|
|
|
|
|
| |||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| πсв(py) | πсв(pz) |
|
|
|
|
|
|
| ||||
|
|
|
|
| s |
|
|
| σр(s) |
|
|
| s | ||||||||
|
|
|
|
|
|
|
|
| σсв(px) |
|
|
|
|
|
|
| |||||
Рис. 2.22. Энергетическая диаграмма молекулярных орбиталей для ns- и np- АО с учетом взаимодействия s и p-электронов
2.22. Энергетическая диаграмма молекулярных орбиталей для ns- и np- АО с учетом взаимодействия s и p-электронов
71
Пример. 1. Распределение валентных электронов по МО молекул и молекулярных ионов элементов первого периода.
Частица |
| h3+ | h30 | h3- | He2+ | He20 | |||
|
|
|
|
|
|
|
|
|
|
Энергетическая | σр |
|
| σр |
|
| σр | σр | σр |
|
|
| |||||||
диаграмма | σсв | σсв | σсв | σсв | σсв | ||||
|
| σсв1 | σсв2 | σсв2σр1 | σсв2σр1 | σсв2σр2 | |||
Электронная |
| ||||||||
конфигурация | 1/2 | 1 |
| 1/2 | 1/2 | 0 | |||
Кратность свя- |
| ||||||||
зи | 255 | 432 | 17 | 232 | 0 | ||||
Энергия связи, | |||||||||
кДж/моль | 1. | 0.74 | — | 1.08 | — | ||||
Длина связи, Å | |||||||||
|
|
|
|
|
|
|
|
|
|
2. Электронная конфигурация молекул (типа А2; АВ) элементов второго периода.
Молекула | Электронная конфи- | Кратность | Энергия | Примечание |
| гурация |
| кДж/моль |
|
Li2 | σсв2 | 1 | 107 | Нет |
Be2 | σсв2σр2 | 0 | − | |
B2 | σсв2σр2πсв2 | 1 | 288 | Парамагнетик |
C2 | σсв2σр2πсв4 | 2 | 629 |
|
N2 | σсв2σр2πсв4σсв2 | 3 | 942 |
|
O2 | σсв2σр2σсв2πсв4 πр2 | 2 | 494 | Парамагнетик |
F2 | σсв2σр2σсв2πсв4 πр4 | 1 | 155 | Нет |
Ne2 | σсв2σр2σсв2πсв4 πр4σр2 | 0 | − | |
CO | σсв2σр2πсв4σсв2 | 3 | 1071 | Аналог N2 |
NO | σсв2σр2πсв4σсв2πр1 | 2. | 628 |
|
NO+ | σсв2σр2πсв4σсв2 | 3 | — | Аналог N2 |
Несмотря на то, что в основе методов ВС и МО лежат различные представления об образовании химической связи в молекулах (в методе ВС рассматривают молекулу как совокупность отдельных взаимодействующих атомов, а в методе МО – как самостоятельное целое), расчеты обоими методами энергии связи и распределения электронной плотности, естественно, приводят к одинаковым результатам. Метод ВС обладает большей наглядностью при описании химической связи. Метод МО использует сравнительно более простой математический аппарат и поэтому широко используется в квантово-механических расчетах. Кроме того метод МО, в отличие от метода ВС, объясняет магнитные свойства молекул.
72
6: Кислотно-основная и донорно-акцепторная химия
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 151393
- 6.
 1: Кислотно-щелочные модели как организационные концепции
1: Кислотно-щелочные модели как организационные концепции - Представление о кислотах и основаниях часто связывают с перемещением ионов водорода от одной молекулы или иона к другой. Тем не менее, было разработано множество концепций кислотно-щелочного взаимодействия, чтобы помочь химикам организовать и понять широкий спектр реакций.
- 6.
- они влияют на количество ионов гидроксония (и, соответственно, ионов гидроксида в водных растворах. Проще говоря, в определении Аррениуса кислота — это вещество, которое увеличивает концентрацию ионов гидроксония при растворении в воде. Обычно это происходит, когда кислота диссоциирует за счет потеря протона водой
- 6.3: Brønsted-Lowry Concept
- 6.3.1: Концепция Brønsted-Lowry
- 6.3.2: Правила большого пальца для размышлений о отношениях между молекулярной структурой и актертозией Brønsted и базовой*
- 6.
 3.3: Кислотно-щелочное поведение бинарных гидридов элементов определяется в первую очередь электроотрицательностью элемента и, во вторую очередь, силой связи элемент-водород.*
3.3: Кислотно-щелочное поведение бинарных гидридов элементов определяется в первую очередь электроотрицательностью элемента и, во вторую очередь, силой связи элемент-водород.* - 6.3.4: Суперкислоты Бренстеда-Лоури и функция кислотности Гаммета
- 6.3.5: Термодинамика кислотности и основности в фазе раствора по Бренстеду
- 6.3.6: Термодинамика кислотности и основности в газовой фазе по Бренстеду
- 6.3.7: Кислотность оксокислоты определяется электроотрицательностью и степенью окисления Центральный атом оксокислоты*
- 6.3.8: Ионы металлов с высоким отношением заряда к размеру действуют как кислоты Бренстеда в воде
- 6.3.9: Кислотно-основная концепция системы растворителей
- 6.3.10: Кислотно-основная химия в амфотерных растворителях и эффект выравнивания растворителя
- 6.3.11: ненуклеофилические супербазы Brønsted-Lowry
- 6.4: Концепция Льюиса и пограничные орбитали
- 6.
 4.1. передача электронов с высшей занятой орбитали основания на низшую незанятую орбиталь кислоты.
4.1. передача электронов с высшей занятой орбитали основания на низшую незанятую орбиталь кислоты. - 6.4.2: При прочих равных условиях электроноакцепторные группы делают кислоты Льюиса более сильными, а основания – более слабыми, в то время как электронодонорные группы делают основания Льюиса более сильными, а кислоты – более слабыми
- 6.4.3: Электронные спектры комплексов с переносом заряда иллюстрируют влияние граничных орбитальных взаимодействий на электронную структуру аддуктов кислот Льюиса
- 6.4.4: Фаза растворов веществ. изменение энтальфии диссоциации его аддукта с эталонной кислотой аналогичной жесткости.
- 6.4.5: В шкале сродства трифторида бора изменение энтальфии при образовании аддукта между основанием и трифторидом бора принимается за меру основности по Льюису.
- 6.4.6: Сила основания Льюиса также может быть оценена путем измерения структурных или энергетических изменений при образовании кислотно-основного комплекса Льюиса, как показано в попытках спектроскопически оценить прочность галогенных связей
- 6.
 4.7: Объемные группы ослабляют силу кислот и оснований Льюиса, потому что они вносят стерическое напряжение в образующийся кислотно-основной аддукт.
4.7: Объемные группы ослабляют силу кислот и оснований Льюиса, потому что они вносят стерическое напряжение в образующийся кислотно-основной аддукт. - 6.4.8: Химия фрустрированных пар Льюиса использует кислотные и основные центры Льюиса в молекуле, которые стерически ограничены от образования аддукта друг с другом. 96.5. Межмолекулярные силы
- 6.
- 6.6: Жесткие и мягкие кислоты и основания
- 6.6.1: Количественные измерения жесткости, мягкости и кислотности Взаимодействия с точки зрения жесткого мягкого кислотно-основного принципа включают орбитальные энергии и/или распределение кислотно-основных связей с точки зрения электростатических и ковалентных факторов
- 6.6.2: Предпочтения Hard-Hard и Soft-Soft могут быть объяснены и количественно определены с точки зрения электростатической, ковалентной и электронной стабилизации стабильности кислотно-основных аддуктов Льюиса
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Глава
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Структурные мономеры донор-акцептор-донор (D-A-D) в качестве донорных материалов в полимерных солнечных элементах: подход DFT/TDDFT
[1] Wolf J, Babics M, Wang K, et al. Бензо[1,2-b:4,5-b′]дитиофен-пиридо[3,4-b]пиразиновые низкомолекулярные доноры для объемных солнечных элементов с гетеропереходом. Хим Матер. 2016;28(7):2058–2066 [Google Scholar]
[2] Wang M, Cai D, Yin Z, et al. Асимметричные сополимеры на основе инденотиофена для объемных солнечных элементов с гетеропереходом с эффективностью 9,14%. Adv Mater. 2016;28(17):3359–3365 [PubMed] [Google Scholar]
[3] Scharber MC, Sariciftci NS.. Эффективность органических солнечных элементов с объемным гетеропереходом. Прог Полим Науки. 2013;38(12):1929–1940 [бесплатная статья PMC] [PubMed] [Google Scholar]
[4] Li G, Zhu R, Yang Y. , et al. Полимерные солнечные батареи. Нат Фотон. 2012;6(3):153–161 [Google Scholar]
, et al. Полимерные солнечные батареи. Нат Фотон. 2012;6(3):153–161 [Google Scholar]
[5] Green MA, Emery K, Hishikawa Y, et al. Таблицы эффективности солнечных элементов Dunlop ED. 45-я версия. прог. Фотовольтаика Рез. заявл. 2015 г.; 23:1–9. [Google Scholar]
[6] Scharber MC, Mühlbacher D, Koppe M, et al. Правила проектирования доноров в солнечных элементах с объемным гетеропереходом — к эффективности преобразования энергии 10%. Adv Mater. 2006;18(6):789–794 [Google Scholar]
[7] Heeger AJ. Полупроводниковые и металлические полимеры: четвертое поколение полимерных материалов (нобелевская лекция). Angew Chem Int Ed Engl. 2001;40(14):2591–2611. [PubMed] [Google Scholar]
[8] Heeger AJ. Полупроводниковые и металлические полимеры: четвертое поколение полимерных материалов. J Phys Chem B. 2001;105(36):8475–8491. [Google Scholar]
[9] Факкетти А. Полимеры с π-сопряжением для применения в органической электронике и фотогальванических элементах. Хим Матер. 2011;23(3):733–758. [Академия Google]
2011;23(3):733–758. [Академия Google]
[10] Улла Х., Тахир А.А., Маллик Т.К. и др. Композиты полипиррол/TiO2 для фотокатализа. Sens Actuators B. 2017; 241:1161–1169. [Google Scholar]
[11] Улла Х. Межмолекулярное взаимодействие в полипирроле/TiO2: исследование DFT. J Сплавы компл. 2017; 692: 140–148. [Google Scholar]
[12] Mishra A, Ma CQ, Bäuerle P., et al. Функциональные олиготиофены: молекулярный дизайн для многомерных наноархитектур и их применения. Chem Rev. 2009;109(3):1141–1276 [PubMed] [Google Scholar]
[13] Перепичка ИФ, Перепичка ДФ. Справочник по материалам на основе тиофена: приложения в органической электронике и фотонике, 2 Набор громкости. Чичестер: Джон Вили и сыновья; 2009 [Google Scholar]
[14] Li M, An C, Pisula W, et al. Циклопентадитиофен-бензотиадиазольные донорно-акцепторные полимеры как прототипы полупроводников для высокоэффективных полевых транзисторов. Acc Chem Res. 2018;51(5):1196–1205. [PubMed] [Google Scholar]
[15] Farinola GM, Ragni R. Электролюминесцентные материалы для белых органических светоизлучающих диодов. Chem Soc Rev. 2011;40(7):3467–3482. [PubMed] [Академия Google]
Электролюминесцентные материалы для белых органических светоизлучающих диодов. Chem Soc Rev. 2011;40(7):3467–3482. [PubMed] [Академия Google]
[16] Хаджиоглу С.О., Токсабай С., Сендур М. и др. Синтез и электрохромные свойства трифениламинсодержащих сополимеров: влияние π-моста на электрохимические свойства. J Polym Sci Part A: Polym Chem. 2014;52(4):537–544. [Google Scholar]
[17] Бхаргав Р., Бхардвадж Д., Шахджад П.А. и др. Поли(3,4-этилендиокситиофен), не содержащий поли(стиролсульфоната), в качестве прочного и пригодного для обработки в растворе слоя переноса дырок для органических солнечных элементов. ХимияВыбрать. 2016;1(7):1347–1352. [Академия Google]
[18] Зарубин В.А., Ли Т.Д., Хумагайн С. и др. Улучшенное анизотропное термоэлектрическое поведение поли(3,4-этилендиокситиофена): поли(стиролсульфонат) с помощью магнитофореза. АСУ Омега. 2018;3(10):12554–12561. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[19] Echeverri M, Martín I, Concellon A, et al. Шум и его влияние на здоровье персонала стоматологического отделения специализированного центра ЦЭС. CES Одонтол . 1989 год; 2(1):13–20. Гутьеррес-Пуэбла, Э.; Серрано, Дж. Л.; Го ´ Мез-Лор, Б. Флуоресцентные и электроактивные моноалкильные жидкие кристаллы на основе BTD с настраиваемой самосборкой и электронными свойствами. АСУ Омега 2018, 3, 11857−11864. [PubMed] [Академия Google]
Шум и его влияние на здоровье персонала стоматологического отделения специализированного центра ЦЭС. CES Одонтол . 1989 год; 2(1):13–20. Гутьеррес-Пуэбла, Э.; Серрано, Дж. Л.; Го ´ Мез-Лор, Б. Флуоресцентные и электроактивные моноалкильные жидкие кристаллы на основе BTD с настраиваемой самосборкой и электронными свойствами. АСУ Омега 2018, 3, 11857−11864. [PubMed] [Академия Google]
[20] Chiu CC, Sheng YC, Lin WJ, et al. Влияние внутренних электроноакцепторных фрагментов в органических сенсибилизаторах D-A- π-A на фотофизические свойства DSSC: вычислительное исследование. АСУ Омега. 2018;3(1):433–445. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[21] Li T, Dai S, Ke Z, et al. Акцептор электронов на основе плавленого триса (тиенотиофена) с сильным поглощением в ближней инфракрасной области для высокоэффективных литых солнечных элементов. Adv Mater. 2018;30(10):1-7. [PubMed: 29334151]. [PubMed] [Академия Google]
[22] Li P, Wang Z, Song C, et al. Жесткие сплавленные π-спейсеры в молекулах типа D–π–A для сенсибилизированных красителем солнечных элементов: численное исследование. J Mater Chem C. 2017;5(44):11454–11465. [Google Scholar]
J Mater Chem C. 2017;5(44):11454–11465. [Google Scholar]
[23] Hosseinzadeh E, Hadipour NL. Влияние структурных вариаций слитого электронно-богатого и электронодефицитного звена в π-спейсере органических красителей AD-π-DA на эффективность сенсибилизированных красителем солнечных элементов: вычислительное исследование. Орг Электрон. 2018;62:43–55. [Академия Google]
[24] Boudreault P-LT, Beaupré S, Leclerc M., et al. Поликарбазолы для пластиковой электроники. Полим хим. 2010;1(2):127–136. [Google Scholar]
[25] Boudreault PLT, Blouin N, Leclerc M., et al. Поли(2,7-карбазол)ы и родственные полимеры. В: Достижения в науке о полимерах. Берлин, Гейдельберг, Германия: Springer; 2008. с. 99–124. [Google Scholar]
[26] Blouin N, Michaud A, Gendron D, et al. К рациональному дизайну производных поли(2,7-карбазола) для солнечных элементов. J Am Chem Soc. 2008;130(2):732–742. [PubMed] [Академия Google]
[27] Wakim S, Aïch B, Tao Y, et al. Зарядоперенос, фотоэлектрические и термоэлектрические свойства производных поли(2,7-карбазола) и поли(индоло[3,2-b]карбазола). Polym Rev. 2008;48(3):432–462. [Google Scholar]
Polym Rev. 2008;48(3):432–462. [Google Scholar]
[28] Nandy BC, Gupta AK, Mittal A, et al. Карбазол: биологическая активность. Дж. Биомед. Фарм Рез . 2014; 3:42–48. [Google Scholar]
[29] Ö Y, Sezer E, Saraç AS., et al. Спектроэлектрохимическое исследование N-этилкарбазола в присутствии акриламида. Полим Интерн. 2001;50(3):271–276. [Академия Google]
[30] Гош С., Беди А., Заде С.С. и др. Донор тиенопиррола и селенофенопиррола, сплавленный с акцептором бензотриазола: микроволновый синтез и электрохимическая полимеризация. RSC Adv. 2015;5(7):5312–5320. [Google Scholar]
[31] Вуаи С.А.Х., Бабу Н.С. Теоретический дизайн донорно-акцепторных (DA) мономеров с малой шириной запрещенной зоны для полимерных солнечных элементов: исследование DFT и TD-DFT. Des Monomers Polym. 2021;24(1):123–135. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[32] Babu NS, Vuai SAH. Теоретические исследования оптоэлектронных и фотоэлектрических свойств полимерных мономеров D–A методом теории функционала плотности (DFT). Des Monomers Polym. 2021;24(1):224–237. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Des Monomers Polym. 2021;24(1):224–237. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[33] Мор Т., Арулмоджи В., Равиндран Р.С. и соавт. DFT и TD-DFT исследование геометрии, электронной структуры и электронного поглощения некоторых сенсибилизаторов красителей, не содержащих металлов, для солнечных элементов, сенсибилизированных красителем. Spectrochim Acta A Mol Biomol Spectrosc. 2015; 135:1066–1073. [PubMed] [Google Scholar]
[34] Xie XH, Shen W, He RX и др. Исследование функционала плотности фурофурановых полимеров как потенциальных материалов для полимерных солнечных элементов. Bull Korean Chem Soc. 2013;34(10):2995–3004. [Академия Google]
[35] Бекке АД. Функциональная плотность термохимия. III. Роль точного обмена. J Chem Phys. 1993;98(7):5648–5652. [Google Scholar]
[36] Frisch MJ, Trucks GW, Schlegel HB., et al. Gaussian 09. Редакция B.03. Питтсбург, Пенсильвания: Gaussian, Inc; 2009. [Google Scholar]
[37] Парр Г., Ян В. Функциональная плотность теории атомов и молекул. Оксфорд, Нью-Йорк: University Press; 1989. [Google Scholar]
Оксфорд, Нью-Йорк: University Press; 1989. [Google Scholar]
[38] Tomasi J, Mennucci B, Cammi R., et al. Квантово-механические модели сольватации континуума. Хим. ред. 2005; 105 (8): 29.99–3093. [PubMed] [Google Scholar]
[39] Kurashige Y, Nakajima T, Kurashige S, et al. Теоретическое исследование возбужденных состояний кумариновых красителей для сенсибилизированных красителем солнечных элементов. J Phys Chem A. 2007;111(25):5544–5548. [PubMed] [Google Scholar]
[40] Zhou H, Yang L, You W., et al. Рациональный дизайн сопряженных полимеров с высокими характеристиками для органических солнечных элементов. J Mater Chem C. 2013;1(44):7266–7293. Макромолекулы . 2012;45(2):607-632; б) Ван Т., Пирсон А.Дж., Лидзей Д.Г. Корреляция молекулярной морфологии с оптоэлектронной функцией в солнечных элементах на основе смесей сополимер с фуллереном с малой шириной запрещенной зоны. [Академия Google]
[41] Масса воздуха Данные ASTM G-173 доступны по адресу. Доступ
2013 апр
9. http://rredc.nrel.gov/solar/spectra/am1.5/
http://rredc.nrel.gov/solar/spectra/am1.5/
[42] Brédas JL, Beljonne D, Coropceanu V, et al. Процессы переноса заряда и энергии в π-сопряженных олигомерах и полимерах: молекулярная картина. Chem Rev. 2004;104(11):4971–5004. [PubMed] [Google Scholar]
[43] Halls JJM, Cornil J, dos Santos DA, et al. Процессы переноса заряда и энергии на границах раздела полимер/полимер: совместное экспериментальное и теоретическое исследование. Физическая версия B. 1999;60(8):5721–5727. [Google Scholar]
[44] Gunes S, Neugebauer H, Sariciftci NS., et al. Сопряженные ¨ органические солнечные элементы на полимерной основе. Chem Rev. 2007;107(4):1324–1338. [PubMed] [Google Scholar]
[45] Brabec CJ, Cravino A, Meer D, et al. Происхождение напряжения холостого хода пластиковых солнечных элементов. Adv Funct Mater. 2001;11(5):374–380. [Google Scholar]
[46] Gadisa A, Svensson M, Andersson MR, et al. Корреляция между потенциалом окисления и напряжением холостого хода композитных солнечных элементов на основе смесей политиофена/производного фуллерена. Appl Phys Lett. 2004;84(9): 1609–1611. [Google Scholar]
Appl Phys Lett. 2004;84(9): 1609–1611. [Google Scholar]
[47] Кането К., Йошино К., Инуиши Ю. и др. Электрические и оптические свойства политиофена, полученного электрохимической полимеризацией. Твердотельный коммун. 1983;46(5):389–391. [Google Scholar]
[48] Jacquemin D, Preat J, Wathelet V, et al. Тиоиндигокрасители: высокоточные видимые спектры с «TD-DFT». J Am Chem Soc. 2006;128(6):2072–2083. [PubMed] [Google Scholar]
[49] Adamo C, Jacquemin D. Расчеты свойств возбужденного состояния с помощью зависящей от времени теории функционала плотности. Acc Chem Res. 2012;45(8):1173–1182. Chem Soc Rev . 2013;42(3):845-856; b) Perrier A, Maurel F, Jacquemin D. Мультифотохромизм одиночной молекулы с диарилэтенами. [Google Scholar]
[50] Каниболоцкий А.Л., Вилела Ф., Форги Дж.С. и др. Четко определенные и монодисперсные линейные и звездообразные молекулы кватерфлуорена-DPP: значение сопряжения и размерности. Adv Mater. 2011;23(18):2093–2097. [PubMed] [Google Scholar]
[51] Khlaifia D, Ewels CP, Massuyeau F, et al. Раскрытие реальных структур олигомеров поли(3-гексилтиофена) (P3HT) в растворе и на поверхности: комбинированное теоретическое и экспериментальное исследование. RSC Adv. 2016;6(61):56174–56182. [Академия Google]
Раскрытие реальных структур олигомеров поли(3-гексилтиофена) (P3HT) в растворе и на поверхности: комбинированное теоретическое и экспериментальное исследование. RSC Adv. 2016;6(61):56174–56182. [Академия Google]
Индуцированное фторированием превращение донора в акцептор в фотогальванических малых молекулах типа A1–D–A2–D–A1
Введение
технологии возобновляемых источников энергии из-за их уникальных преимуществ легкого веса, простоты изготовления и возможности изготовления гибких устройств большой площади (Forrest, 2004; Brabec et al., 2010; Kumar and Chand, 2012). В типичном органическом фотоэлектрическом (OPV) устройстве BHJ гетеропереход обычно состоит из донора электронов p-типа и акцептора электронов n-типа, который является фотоактивной частью для преобразования солнечного света в электричество. Донором электронов p-типа могут быть полимеры или органические малые молекулы. К акцепторам электронов n-типа относятся производные фуллерена, такие как [6, 6]-фенил-C 61 /C 71 -метиловый эфир масляной кислоты (PC 61 BM/PC 71 BM) и нефуллереновые акцепторы электронов. Для высокоэффективной БГД ОПВ ее активный слой должен обладать следующими характеристиками: (а) широкий спектр поглощения с высоким коэффициентом ослабления для использования большего количества солнечных фотонов; (b) подходящее выравнивание молекулярного уровня энергии между задействованными молекулярными орбиталями на доноре и акцепторе, чтобы обеспечить достаточную движущую силу для эффективного разделения зарядов; (c) бинепрерывная сетка с наноразмерным разделением фаз для облегчения диффузии экситонов и разделения зарядов; и (d) высокая подвижность заряда для облегчения переноса заряда (Scharber et al., 2006; Chen and Cao, 2009).; Ченг и др., 2009 г.; Божуж и Фреше, 2011 г.; Хенсон и др., 2012; Ли, 2012 г.; Сюй и Ю, 2014 г.; Etxebarria и др., 2015; Чжан Х. и др., 2015). Среди этих ключевых особенностей разница в энергии НСМО донора и акцептора обычно превышает 0,3 эВ в фуллереновой системе (Scharber and Sariciftci, 2013). Однако с разработкой и применением нефуллереновых акцепторов электронов было обнаружено, что нет четкой границы между материалами-донорами и акцепторами электронов, и разница энергий НСМО или ВЗМО в нефуллереновой системе может быть очень небольшой.
Для высокоэффективной БГД ОПВ ее активный слой должен обладать следующими характеристиками: (а) широкий спектр поглощения с высоким коэффициентом ослабления для использования большего количества солнечных фотонов; (b) подходящее выравнивание молекулярного уровня энергии между задействованными молекулярными орбиталями на доноре и акцепторе, чтобы обеспечить достаточную движущую силу для эффективного разделения зарядов; (c) бинепрерывная сетка с наноразмерным разделением фаз для облегчения диффузии экситонов и разделения зарядов; и (d) высокая подвижность заряда для облегчения переноса заряда (Scharber et al., 2006; Chen and Cao, 2009).; Ченг и др., 2009 г.; Божуж и Фреше, 2011 г.; Хенсон и др., 2012; Ли, 2012 г.; Сюй и Ю, 2014 г.; Etxebarria и др., 2015; Чжан Х. и др., 2015). Среди этих ключевых особенностей разница в энергии НСМО донора и акцептора обычно превышает 0,3 эВ в фуллереновой системе (Scharber and Sariciftci, 2013). Однако с разработкой и применением нефуллереновых акцепторов электронов было обнаружено, что нет четкой границы между материалами-донорами и акцепторами электронов, и разница энергий НСМО или ВЗМО в нефуллереновой системе может быть очень небольшой. Например, акцептор полимера P-BNBP-fBT имеет уровень НСМО, равный -3,6 эВ, а донор PTB7-Th имеет уровень НСМО, равный -3,42 эВ. Устройство на основе PTB7-Th/P-BNBP-fBT показало эффективность передачи энергии (PCE) до 6,26%, хотя разница в уровнях LUMO составляет всего 0,18 эВ (Long et al., 2016). Однако полимерные материалы обычно имеют большую полидисперсность по молекулярной массе, что увеличивает сложность материалов. Таким образом, когда дело доходит до точной настройки молекулярных уровней, использование малых молекул, пригодных для обработки в растворе, важно для понимания взаимосвязи между молекулярными структурами и их электронодонорными/акцепторными свойствами (Zhu et al., 2016; Wu et al., 2017). ).
Например, акцептор полимера P-BNBP-fBT имеет уровень НСМО, равный -3,6 эВ, а донор PTB7-Th имеет уровень НСМО, равный -3,42 эВ. Устройство на основе PTB7-Th/P-BNBP-fBT показало эффективность передачи энергии (PCE) до 6,26%, хотя разница в уровнях LUMO составляет всего 0,18 эВ (Long et al., 2016). Однако полимерные материалы обычно имеют большую полидисперсность по молекулярной массе, что увеличивает сложность материалов. Таким образом, когда дело доходит до точной настройки молекулярных уровней, использование малых молекул, пригодных для обработки в растворе, важно для понимания взаимосвязи между молекулярными структурами и их электронодонорными/акцепторными свойствами (Zhu et al., 2016; Wu et al., 2017). ).
В настоящее время малые молекулы могут быть созданы как доноры или акцепторы на основе различных молекулярных архитектур. Для доноров малых молекул сопряженный скелет чаще всего относительно плоский. Например, низкомолекулярный донор на основе олиготиофена DRCN7T продемонстрировал впечатляющий оптимизированный PCE 9,30% с использованием акцептора PC 71 BM (Zhang Q. et al., 2015). Наша группа синтезировала электронодонорную малую молекулу со структурой A1–D–A2–D–A1 с PCE более 9% с повышенной молекулярной планарностью и кристалличностью (Yuan et al., 2016). С другой стороны, в настоящее время нефуллереновые акцепторы в основном сосредоточены на акцепторах с конденсированными кольцами (Cheng et al., 2018; Hou et al., 2018). Акцепторы на основе перилендиимида (PDI) или нафталиндиимида (NDI) показали относительно хорошие результаты в PSC (Facchetti, 2013; Zhang et al., 2013; Hartnett et al., 2014; Li et al., 2014; Lin et al. al., 2014; Jung et al., 2015; Liu et al., 2015; Sun et al., 2015; Yang et al., 2016; Lei et al., 2018). Большинство высокоэффективных акцепторов, не содержащих фуллеренов, на основе PDI и NDI имеют скрученные основные цепи, чтобы уменьшить планарность, самоагрегацию и кристаллические домены простых рилендиимидов. Помимо свободных от фуллеренов акцепторов электронов на основе рилена в низкомолекулярных акцепторах широко использовались электронодонорные удлиненные конденсированные кольца, например, индаценодитиофен (IDT) и индаценодитиено[3,2-b]тиофен (IDTT), поскольку их уровни НСМО могут быть легко настроены путем фланкирования с различными электроноакцепторными группами, а стерический эффект тетрагексилфенильных заместителей на компланарной основной цепи может уменьшить межмолекулярные взаимодействия, ослабляя укладку донорных единиц и способствуя укладке акцепторных единиц (Lin et al.
et al., 2015). Наша группа синтезировала электронодонорную малую молекулу со структурой A1–D–A2–D–A1 с PCE более 9% с повышенной молекулярной планарностью и кристалличностью (Yuan et al., 2016). С другой стороны, в настоящее время нефуллереновые акцепторы в основном сосредоточены на акцепторах с конденсированными кольцами (Cheng et al., 2018; Hou et al., 2018). Акцепторы на основе перилендиимида (PDI) или нафталиндиимида (NDI) показали относительно хорошие результаты в PSC (Facchetti, 2013; Zhang et al., 2013; Hartnett et al., 2014; Li et al., 2014; Lin et al. al., 2014; Jung et al., 2015; Liu et al., 2015; Sun et al., 2015; Yang et al., 2016; Lei et al., 2018). Большинство высокоэффективных акцепторов, не содержащих фуллеренов, на основе PDI и NDI имеют скрученные основные цепи, чтобы уменьшить планарность, самоагрегацию и кристаллические домены простых рилендиимидов. Помимо свободных от фуллеренов акцепторов электронов на основе рилена в низкомолекулярных акцепторах широко использовались электронодонорные удлиненные конденсированные кольца, например, индаценодитиофен (IDT) и индаценодитиено[3,2-b]тиофен (IDTT), поскольку их уровни НСМО могут быть легко настроены путем фланкирования с различными электроноакцепторными группами, а стерический эффект тетрагексилфенильных заместителей на компланарной основной цепи может уменьшить межмолекулярные взаимодействия, ослабляя укладку донорных единиц и способствуя укладке акцепторных единиц (Lin et al. , 2015; Wu et al., 2015; Lin and Zhan, 2016; Huang et al., 2017; Yu et al., 2017). Другой пример был представлен Hou et al., стерические затруднения, вызванные боковыми цепями, могут превращать два изомера в доноры и акцепторы по отдельности (Liu et al., 2018). В этом случае молекулы со слабой структурой π-π-стекинга с большей вероятностью будут работать как акцепторные материалы. Хотя недавний прогресс показал, что малые молекулы, основанные на одной и той же основной цепи, могут превращаться из донорных в акцепторные путем изменения сопротивления боковой цепи, до сих пор неясно, можно ли слегка настроить энергетические уровни более плоских малых молекул и подвижность заряда, чтобы реализовать преобразование из донор к акцептору.
, 2015; Wu et al., 2015; Lin and Zhan, 2016; Huang et al., 2017; Yu et al., 2017). Другой пример был представлен Hou et al., стерические затруднения, вызванные боковыми цепями, могут превращать два изомера в доноры и акцепторы по отдельности (Liu et al., 2018). В этом случае молекулы со слабой структурой π-π-стекинга с большей вероятностью будут работать как акцепторные материалы. Хотя недавний прогресс показал, что малые молекулы, основанные на одной и той же основной цепи, могут превращаться из донорных в акцепторные путем изменения сопротивления боковой цепи, до сих пор неясно, можно ли слегка настроить энергетические уровни более плоских малых молекул и подвижность заряда, чтобы реализовать преобразование из донор к акцептору.
В данном документе мы разработали и синтезировали три новые небольшие молекулы типа A1–D–A2–D–A1 с диалкоксифенилдитиофеном (PDT) в качестве звена D, дифторированным бензотиадиазолом (2FBT) в качестве звена A2 и сильной электроноакцепторной группой 1, 1- дицианометилен-3-инданон (IC), замещенный 0–2 заместителями фтора в качестве концевого A1, а именно M-0F, M-1F и M-2F. Все три молекулы демонстрируют хорошую планарность. Молекулярные структуры показаны на схеме 1. Фтор является наиболее электроотрицательным элементом с относительно небольшим ван-дер-ваальсовым радиусом. Он может служить электроноакцепторной группой, не создавая нежелательных стерических затруднений. Введение фтора в сопряженную основу полимеров или малых молекул для солнечных элементов BHJ может снизить уровень НСМО и ВЗМО (Price et al., 2011; Zhou et al., 2011; Zhang et al., 2017; Zhao et al. , 2017). Фторирование IC также способствует межмолекулярным взаимодействиям за счет образования нековалентных связей F-S и F-H, которые могут быть благоприятны для переноса заряда (Sakamoto et al., 2001; Lei et al., 2014; Kim et al., 2015). Молекулы-мишени демонстрируют спектр поглощения со смещением в красную область, а их энергии LUMO и HOMO уменьшаются с увеличением фторирования. В качестве донора M-0F продемонстрировал самый высокий PCE 5,9.9%, M-1F показал PCE 2,60%, а M-2F показал самый низкий PCE 0,97% с PC 71 BM в качестве акцептора.
Все три молекулы демонстрируют хорошую планарность. Молекулярные структуры показаны на схеме 1. Фтор является наиболее электроотрицательным элементом с относительно небольшим ван-дер-ваальсовым радиусом. Он может служить электроноакцепторной группой, не создавая нежелательных стерических затруднений. Введение фтора в сопряженную основу полимеров или малых молекул для солнечных элементов BHJ может снизить уровень НСМО и ВЗМО (Price et al., 2011; Zhou et al., 2011; Zhang et al., 2017; Zhao et al. , 2017). Фторирование IC также способствует межмолекулярным взаимодействиям за счет образования нековалентных связей F-S и F-H, которые могут быть благоприятны для переноса заряда (Sakamoto et al., 2001; Lei et al., 2014; Kim et al., 2015). Молекулы-мишени демонстрируют спектр поглощения со смещением в красную область, а их энергии LUMO и HOMO уменьшаются с увеличением фторирования. В качестве донора M-0F продемонстрировал самый высокий PCE 5,9.9%, M-1F показал PCE 2,60%, а M-2F показал самый низкий PCE 0,97% с PC 71 BM в качестве акцептора. С другой стороны, в качестве акцептора M-0F показал самый низкий PCE 0,58%, M-1F показал средний PCE 1,85%, а M-2F достиг самого высокого PCE 2,65% с полимером PBDB-T в качестве донора. Разница в уровне энергии в определенной степени влияет на характеристики молекулы: M-0F продемонстрировал тот же уровень НСМО, что и PBDB-T, и не может обеспечить достаточную движущую силу для переноса заряда и разделения, но для M-2F его более низкий уровень НСМО составляет относительно лучшее совпадение с PBDB-T, хотя разница LUMO невелика. С другой стороны, подвижность дырок и электронов также показывает, что переход от транспорта дырок к транспорту электронов может быть осуществлен посредством фторирования.
С другой стороны, в качестве акцептора M-0F показал самый низкий PCE 0,58%, M-1F показал средний PCE 1,85%, а M-2F достиг самого высокого PCE 2,65% с полимером PBDB-T в качестве донора. Разница в уровне энергии в определенной степени влияет на характеристики молекулы: M-0F продемонстрировал тот же уровень НСМО, что и PBDB-T, и не может обеспечить достаточную движущую силу для переноса заряда и разделения, но для M-2F его более низкий уровень НСМО составляет относительно лучшее совпадение с PBDB-T, хотя разница LUMO невелика. С другой стороны, подвижность дырок и электронов также показывает, что переход от транспорта дырок к транспорту электронов может быть осуществлен посредством фторирования.
Схема 1 . Химическая структура молекул M-0F, M-1F, M-2F.
Результаты и обсуждение
Молекулярный синтез и свойства
Все три молекулы-мишени M-0F, M-1F, M-2F были синтезированы в соответствии с маршрутом, показанным на схеме 1. Чтобы обеспечить растворимость этих трех материалов, длинные был выбран октилдодецилокси с разветвленной боковой цепью. Соединение PDT2FBT-CHO было получено по реакции Вильсмейера из О-1. Три молекулы-мишени были синтезированы по реакции Кнёвенагеля. Синтетические пути, методы очистки и данные спектроскопии ядерного магнитного резонанса представлены во вспомогательной информации.
Соединение PDT2FBT-CHO было получено по реакции Вильсмейера из О-1. Три молекулы-мишени были синтезированы по реакции Кнёвенагеля. Синтетические пути, методы очистки и данные спектроскопии ядерного магнитного резонанса представлены во вспомогательной информации.
На рисунках 1A, B показаны нормализованные спектры поглощения в УФ-видимой области M-0F, M-1F и M-2F, измеренные в растворе хлороформа и в тонких твердых пленках. Подробные параметры приведены в таблице 1. В растворе три молекулы демонстрируют сходные спектры поглощения, где введение фтора приводит к смещению спектра поглощения в красную область с максимальным пиком поглощения, смещающимся от 623 до 630 и 638 нм. В тонких пленках все три молекулы демонстрируют большее смещение в красную область и более широкий спектр поглощения. Пики поглощения этих трех соединений постепенно смещаются в красную сторону от 697 до 705 нм, а затем до 712 нм в тонких твердых пленках. Сильные плечевые пики показывают, что три молекулы имеют хорошую π-π-стэкинг в пленке (Badgujar et al. , 2016). Рассчитанные оптические запрещенные зоны M-0F, M-1F и M-2F составляют 1,64, 1,59 и 1,60 эВ от края поглощения соответственно.
, 2016). Рассчитанные оптические запрещенные зоны M-0F, M-1F и M-2F составляют 1,64, 1,59 и 1,60 эВ от края поглощения соответственно.
Рис. 1. (A) Нормированные спектры поглощения в УФ-видимой области M-0F, M-1F и M-2F, PC 71 BM, PBDB-T в хлороформе и (B) в тонкой пленке (К) Циклические вольтамперограммы M-0F, M-1F и M-2F (D) Диаграмма уровня энергии родственных материалов, используемых в устройстве.
Таблица 1 . Оптические и электрохимические данные соединений М1-0Ф, М1-1Ф и М1-2Ф.
Циклическая вольтамперометрия (CV) использовалась для оценки электрохимических свойств трех малых молекул, и результаты показаны на рисунках 1C,D с обратимыми волнами восстановления и квазиобратимыми волнами окисления. Энергетические уровни ВЗМО и НСМО рассчитываются исходя из начальных потенциалов окисления и восстановления, предполагая, что абсолютный уровень энергии FeCp2+/0 на 4,8 эВ ниже вакуума. Уравнение энергетических уровней ВЗМО имеет вид E HOMO = –e (Eox + 4.8–E 1/2 , (Fc/Fc + )) и уравнение уровней энергии НСМО: E НСМО = –e (E RED + 4.8 –E 1/2 , (Fc/Fc + )) (Li et al., 1999). Из-за сильной электроноакцепторной способности атома фтора ВЗМО и НСМО как M-1F, так и M-2F смещаются вниз. Уровни ВЗМО M-0F, M-1F и M-2F оцениваются как -5,45, -5,50 и -5,54 эВ, а уровни НСМО составляют -3,52, -3,54 до -3,55 эВ (рис. 1D).
Уравнение энергетических уровней ВЗМО имеет вид E HOMO = –e (Eox + 4.8–E 1/2 , (Fc/Fc + )) и уравнение уровней энергии НСМО: E НСМО = –e (E RED + 4.8 –E 1/2 , (Fc/Fc + )) (Li et al., 1999). Из-за сильной электроноакцепторной способности атома фтора ВЗМО и НСМО как M-1F, так и M-2F смещаются вниз. Уровни ВЗМО M-0F, M-1F и M-2F оцениваются как -5,45, -5,50 и -5,54 эВ, а уровни НСМО составляют -3,52, -3,54 до -3,55 эВ (рис. 1D).
Характеристики фотоэлектрических устройств
Для исследования фотоэлектрического поведения трех молекул в качестве донора и акцептора электронов в устройствах OPV мы выбрали два материала: PC 71 BM в качестве акцептора (Wienk et al., 2003; Thompson and Fréchet, 2008) и PBDB. -T в качестве полимера-донора (Zhao et al., 2016) для смешивания с M-0F, M-1F, M-2F для изготовления стандартной структуры устройства: ITO/PEDOT:PSS/донор:акцептор/Ca/Al. Мы сравнительно изучили фотоэлектрические характеристики M-0F, M-1F и M-2F в качестве донорных материалов. Устройства были изготовлены из смеси низкомолекулярных доноров и PC 9.0304 71 BM с хлороформом в качестве растворителя методом центрифугирования. Фотогальванические свойства устройств были охарактеризованы при освещении моделируемым солнечным светом AM1,5G (100 мВт/см -2 ). Оптимизированные кривые зависимости плотности тока от напряжения (J-V) и соответствующие им кривые внешней квантовой эффективности (EQE) показаны на рисунке 2. Соответствующие данные о производительности фотоэлектрических систем обобщены в таблице 2. Данные о производительности фотоэлектрических систем для других условий обобщены в таблицах S1. , С2. Устройство на базе М-0Ф: ПК 71 BM демонстрировал высокий V OC 1,01 В, J SC из 9,54 MACM — 2 77 из 9,54 MACM — 2 77. 5,99%. Для устройства M-1F: PC 71 BM, PCE составлял 2,60% с V OC из 0,91 В, J SC из 5.
Устройства были изготовлены из смеси низкомолекулярных доноров и PC 9.0304 71 BM с хлороформом в качестве растворителя методом центрифугирования. Фотогальванические свойства устройств были охарактеризованы при освещении моделируемым солнечным светом AM1,5G (100 мВт/см -2 ). Оптимизированные кривые зависимости плотности тока от напряжения (J-V) и соответствующие им кривые внешней квантовой эффективности (EQE) показаны на рисунке 2. Соответствующие данные о производительности фотоэлектрических систем обобщены в таблице 2. Данные о производительности фотоэлектрических систем для других условий обобщены в таблицах S1. , С2. Устройство на базе М-0Ф: ПК 71 BM демонстрировал высокий V OC 1,01 В, J SC из 9,54 MACM — 2 77 из 9,54 MACM — 2 77. 5,99%. Для устройства M-1F: PC 71 BM, PCE составлял 2,60% с V OC из 0,91 В, J SC из 5. 14 MA/C 2 SC из 5.14 MA/C 2 . Однако для прибора М-2Ф: ПК 71 БМ КПД составил всего 0,9.7% с V OC 0,93 В, J SC 1,80 мАсм −2 и FF 57,65%. Можно сделать вывод, что в качестве донора электронов в смесях с PC 71 BM M-0F демонстрирует превосходные фотоэлектрические характеристики по сравнению с M-1F, в то время как M-1F имеет лучшие фотоэлектрические характеристики, чем M-2F. Результаты показывают, что производительность устройства на основе трех молекул в качестве доноров снижается с увеличением числа атомов фтора, присоединенных к концевым акцепторным звеньям (A1).
14 MA/C 2 SC из 5.14 MA/C 2 . Однако для прибора М-2Ф: ПК 71 БМ КПД составил всего 0,9.7% с V OC 0,93 В, J SC 1,80 мАсм −2 и FF 57,65%. Можно сделать вывод, что в качестве донора электронов в смесях с PC 71 BM M-0F демонстрирует превосходные фотоэлектрические характеристики по сравнению с M-1F, в то время как M-1F имеет лучшие фотоэлектрические характеристики, чем M-2F. Результаты показывают, что производительность устройства на основе трех молекул в качестве доноров снижается с увеличением числа атомов фтора, присоединенных к концевым акцепторным звеньям (A1).
Рис. 2. (A,B) Кривые J–V и кривые EQE для M-0F, M-1F, M-2F со смесями PC 71 BM при наилучших рабочих условиях. (C,D) Кривые J-V и кривые EQE для M-0F, M-1F, M-2F со смесями PBDB-T при наилучших рабочих условиях.
Таблица 2 . Исполнение устройства М-0Ф, М-1Ф, М-2Ф с ПК 71 БМ в качестве акцепторов.
Исполнение устройства М-0Ф, М-1Ф, М-2Ф с ПК 71 БМ в качестве акцепторов.
Мы также изучили фотогальванические характеристики M-0F, M-1F и M-2F в качестве материала-акцептора электронов с PBDB-T в качестве материала-донора. Смесь низкомолекулярного акцептора и PBDB-T была приготовлена с использованием хлорбензола в качестве растворителя методом центрифугирования. Было обнаружено, что PCE устройства M-0F:PBDB-T составляет всего 0,58% при низком уровне 9.0376 J SC и FF; КПЭ устройства на основе М-1Ф:ПБДБ-Т – 1,85 %; в то время как устройство на основе M-2F:PBDB-T показало PCE до 2,65%, с V OC 0,95, J SC 20305 6,23 мА4см и FF 44,54%. Можно сделать вывод, что в качестве акцепторов электронов после смешивания с PBDB-T M-2F демонстрирует превосходные фотоэлектрические характеристики по сравнению с M-0F и M-1F. Это означает, что в качестве акцепторов и доноров ряд малых молекул демонстрирует противоположную тенденцию в характеристиках устройства. С увеличением фторирования характеристики устройства в качестве донора снижаются, а в качестве акцептора улучшаются.
С увеличением фторирования характеристики устройства в качестве донора снижаются, а в качестве акцептора улучшаются.
Эффекты тушения фотолюминесценции
Для исследования донорных свойств M-0F, M-1F и M-2F были измерены спектры флуоресценции в диапазоне 680–900 нм с длиной волны возбуждения 650 нм. Как показано на рисунке S1A, фотолюминесценция (ФЛ) M-0F, M-1F может быть частично погашена PC 71 BM, тогда как ФЛ M-2F почти не может быть погашена PC 71 BM, что свидетельствует о диссоциации экситона в смеси М-0Ф/ПК 71 БМ, М-1Ф/ПК 71 БМ должен быть более эффективным, чем в смеси М-2Ф/ПК 71 БМ. Для изучения акцепторных свойств этих трех малых молекул была выбрана длина волны возбуждения 740 нм, как показано на рисунке S1B. От пленки M-0F/PBDB-T, M-1F/PBDB-T до M-2F/PBDB-T эффект гашения ФЛ постепенно усиливается, что указывает на то, что диссоциация экситона постепенно становится более эффективной. Эти результаты согласуются с производительностью устройства.
Морфология и микроструктура пленки
С помощью атомно-силовой микроскопии (АСМ) и просвечивающей электронной микроскопии (ПЭМ) была исследована морфология фазового разделения смесей для двух систем. Как показано на рисунке 3, изображения АСМ согласуются с изображениями ПЭМ. Для системы PC 71 BM видно, что M-0F, M-1F и M-2F имеют хорошую совместимость с PC 71 BM и хорошее разделение фаз. Шероховатость поверхности 8,317, 4,236 и 4,617 нм для смесевых пленок М-0Ф:ПК 71 БМ, М-1Ф:ПК 71 БМ и М-2Ф:ПК 71 БМ соответственно. Смесь M-0F:PC 71 BM имеет больший размер области фазы агрегации и правильный размер домена для эффективной диффузии и диссоциации экситонов, что способствует высоким J SC и FF. Для смешанной пленки M-1F:PC 71 BM и M-2F:PC 71 BM размер агрегата настолько мал, что приводит к низким значениям J SC и FF.
Рисунок 3 . АСМ в режиме постукивания (A,D,G) Топография и (B,E,H) фазовые изображения и (C,F,I) ПЭМ-изображения (A–C) M-0F/ PC 71 BM, (D–F) M-1F/PC 71 BM, (G–I) M-2F/PC 71 Смесевые пленки BM.
Для нефуллереновой системы, показанной на рис. 4, шероховатость поверхности смесевой пленки PBDB-T:M-0F, PBDB-T:M-1F и PBDB-T:M-2F составляет 11,034, 6,672 и 4,356. нм. Поверхность ПБДБ-Т:М-2Ф более гладкая. На ПЭМ-изображении видно, что PBDB-T:M-2F образует однородное наноразмерное разделение фаз с нановолокнами и непрерывной взаимопроникающей сетчатой структурой, а размер разделения фаз является подходящим, что облегчает диффузию экситонов и перенос заряда и улучшает J SC и FF. Однако для смесей PBDB-T:M-0F и PBDB-T:M-1F можно увидеть большой размер домена, что не способствует переносу заряда, что оказывает негативное влияние на J SC . и ФФ.
и ФФ.
Рисунок 4 . АСМ в режиме постукивания (A,D,G) Топография и (B,E,H) фазовые изображения и (C,F,I) ПЭМ-изображения (A–C) PBDB-T/ М-0Ф, (Д–Ф) ПБДБ-Т/М-1Ф, (G–I) Смесевые пленки PBDB-T/M-2F.
Для дальнейшего изучения свойств молекулярной укладки и кристаллизации активного слоя применяли широкоугольное рассеяние рентгеновских лучей со скользящим падением (GIWAXS) на чистых пленках и смешанных пленках. Результаты нетронутых пленок M-0F, M-1F, M-2F и PBDB-T показаны на рисунке S2. В плоскостном направлении M-0F, M-1F и M-2F все демонстрируют пики π-π суммирования при 1,72 Å −1 (расстояние d: 3,65 Å), 1,77 Å −1 (расстояние d: 3,55 Å), 1,78 Å -1 (расстояние d: 3,53 Å), что указывает на более высокую кристалличность M-1F и M-2F по сравнению с M-0F в чистых пленках. На рис. 5 показаны двумерные шаблоны GIWAXS и одномерные разрезы GIWAXS вдоль плоскостного и внеплоскостного направлений M-0F:PC 71 BM, M-1F:PC 71 BM и M -2F:PC 71 BM смешанные пленки. Как видно из рисунка 5, M-0F, M-1F и M-2F демонстрируют очень отчетливые дифракционные пики (100), (200), (300) и (010), указывающие на хорошую кристалличность M- 0F, M-1F и M-2F со структурой упорядоченного агрегатного состояния. Кроме того, эти соответствующие пики имеют почти одинаковое положение, что указывает на одинаковый интервал d. Положения пика (100) ~0,298 Å -1 , что соответствует d-расстоянию ~21,08 Å. Положения (010) q составляют ~ 1,869 Å -1 , поэтому расстояние d составляет ~ 3,36 Å. Укладка π-π M-1F сильнее, а подвижность дырок не самая высокая по сравнению с M-0F, M-2F, что указывает на изменение характеристик донора и акцептора.
Как видно из рисунка 5, M-0F, M-1F и M-2F демонстрируют очень отчетливые дифракционные пики (100), (200), (300) и (010), указывающие на хорошую кристалличность M- 0F, M-1F и M-2F со структурой упорядоченного агрегатного состояния. Кроме того, эти соответствующие пики имеют почти одинаковое положение, что указывает на одинаковый интервал d. Положения пика (100) ~0,298 Å -1 , что соответствует d-расстоянию ~21,08 Å. Положения (010) q составляют ~ 1,869 Å -1 , поэтому расстояние d составляет ~ 3,36 Å. Укладка π-π M-1F сильнее, а подвижность дырок не самая высокая по сравнению с M-0F, M-2F, что указывает на изменение характеристик донора и акцептора.
Рисунок 5 . 2D-шаблоны GIWAXS M-0F/PC 71 BM (A) , M-1F/PC 71 BM (B) и M-2F/PC 71 BM (C) смешанная пленка. Вырезы вне плоскости (D) и в плоскости (E) соответствующих 2D-шаблонов GIWAXS.
На рис. 6 показаны GIWAXS пленок смесей PBDB-T:M-0F, PBDB-T:M-1F и PBDB-T:M-2F. Подобно системе PC 71 BM, M-0F, M-1F и M-2F все демонстрируют очень отчетливые дифракционные пики (100), (200), (300) и (010), эти соответствующие пики имеют почти то же место. Позиции (100) q составляют ~ 0,30 Å −1 , поэтому расстояние d составляет ~ 20,94 Å. Положения (010) q составляют ~ 1,83 Å -1 , поэтому расстояние d составляет ~ 3,43 Å. Результаты GIWAXS показывают хорошую кристаллизацию M-0F, M-1F и M-2F.
Рисунок 6 . 2D-модели GIWAXS смешанной пленки PBDB-T/M-0F (A) , PBDB-T/M-1F (B) и PBDB-T/M-2F (C) . Вырезы вне плоскости (D) и в плоскости (E) соответствующих 2D-шаблонов GIWAXS.
Подвижность дырок и электронов
Для изучения происхождения наблюдаемых различий в фотогальванических свойствах трех новых материалов, с использованием космических метод ограниченного заряда (SCLC) (Blom et al. , 2005). Кривые подвижности дырок и электронов, измеренные методом SCLC, показаны на рисунке S3 с дополнительной информацией. Данные по подвижности дырок и электронов в различных условиях приведены в таблице 3. Подвижности дырок и электронов для исходного M-0F составляют 2,49.? Для исходного M-1F подвижность дырок и электронов составляет 1,78 × 10 −5 и 3,03 × 10 −6 см 2 В −1 S −1 . Для исходного M-2F подвижность дырок и электронов составляет 6,42 × 10 −6 и 1,26 × 10 −5 см 2 В −1 S −1 . Это свидетельствует о переходе от дырочного транспорта к электронному. Среди M-1F и M-2F подвижность электронов M-2F выше, чем подвижность дырок, поэтому M-2F обладает лучшими свойствами полупроводника n-типа, чем M-1F. При соответствующих условиях наилучшей производительности, начиная с M-0F:PC 71 BM, M-1F:PC 71 BM до M-2F:PC 71 BM, снижается подвижность как дырок, так и электронов.
, 2005). Кривые подвижности дырок и электронов, измеренные методом SCLC, показаны на рисунке S3 с дополнительной информацией. Данные по подвижности дырок и электронов в различных условиях приведены в таблице 3. Подвижности дырок и электронов для исходного M-0F составляют 2,49.? Для исходного M-1F подвижность дырок и электронов составляет 1,78 × 10 −5 и 3,03 × 10 −6 см 2 В −1 S −1 . Для исходного M-2F подвижность дырок и электронов составляет 6,42 × 10 −6 и 1,26 × 10 −5 см 2 В −1 S −1 . Это свидетельствует о переходе от дырочного транспорта к электронному. Среди M-1F и M-2F подвижность электронов M-2F выше, чем подвижность дырок, поэтому M-2F обладает лучшими свойствами полупроводника n-типа, чем M-1F. При соответствующих условиях наилучшей производительности, начиная с M-0F:PC 71 BM, M-1F:PC 71 BM до M-2F:PC 71 BM, снижается подвижность как дырок, так и электронов. От PBDB-T:M-0F, PBDB-T:M-1F до PBDB-T:M-2F подвижность как дырок, так и электронов увеличивается, что согласуется с результатами фотогальванических характеристик.
От PBDB-T:M-0F, PBDB-T:M-1F до PBDB-T:M-2F подвижность как дырок, так и электронов увеличивается, что согласуется с результатами фотогальванических характеристик.
Таблица 3 . SCLC измерил подвижность дырок и подвижность электронов для чистых M-0F, M-1F, M-2F и их смесей PC 71 BM или PBDB-T.
На основании приведенных выше наблюдений можно сделать вывод, что M-0F обладает хорошими донорными свойствами с лучшим фазовым разделением и более высокой подвижностью дырок в фуллереновой системе. в то время как M-2F обладает лучшими акцепторными свойствами с морфологией взаимопроникающей сетки нановолокон и более высокой подвижностью электронов в нефуллереновой системе.
Заключение
В заключение, мы разработали и синтезировали три новые малые молекулы A1-D-A2-D-A1 (M-0F, M-1F и M-2F) с сильной электроноакцепторной группой 1,1- дицианометилен-3-инданон (IC), замещенный различным числом атомов фтора. С увеличением числа атомов фтора спектры поглощения смещаются в красную область, а энергии как НСМО, так и ВЗМО уменьшаются. M-0F продемонстрировал отличные электронодонорные свойства, в то время как M-2F показал отличные электроноакцепторные свойства. Наша работа еще раз доказывает, что определение донора и акцептора не имеет четких границ, что открывает широкие возможности для молекулярного дизайна. Регулирование уровней энергии и подвижности носителей является одним из эффективных способов достижения этой трансформации. Кроме того, стоит изучить границу между донорными и акцепторными материалами для понимания глубинного механизма диссоциации экситонов и переноса заряда в активных слоях BHJ.
M-0F продемонстрировал отличные электронодонорные свойства, в то время как M-2F показал отличные электроноакцепторные свойства. Наша работа еще раз доказывает, что определение донора и акцептора не имеет четких границ, что открывает широкие возможности для молекулярного дизайна. Регулирование уровней энергии и подвижности носителей является одним из эффективных способов достижения этой трансформации. Кроме того, стоит изучить границу между донорными и акцепторными материалами для понимания глубинного механизма диссоциации экситонов и переноса заряда в активных слоях BHJ.
Авторские взносы
РЗ разработал проект, завершил синтез, характеристику, написал первый вариант рукописи; BX разработал проект, завершил устройство и определение характеристик фотогальванических характеристик. Б.Л., К.Л. и З.В. руководили проектом и помогали редактировать рукопись. Другие авторы внесли свой вклад в синтез или анализ данных.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы признательны Министерству науки и технологий Китая (№ 2016YFA0200700 и 2016YFF0203803), Национальному фонду естественных наук Китая (гранты № 21474022, 21125420, 21603044, 516730603 и 40 Nova 21603), Пекинской программе , Ассоциация содействия инновациям молодежи CAS и Академия наук Китая.
Дополнительный материал
Дополнительный материал к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fchem.2018.00384/full#supplementary-material
Ссылки
Badgujar, S., Lee, G.Y., Park, T., Song, C.E., Park, S., Oh, S., et al. (2016). Высокоэффективная малая молекула за счет адаптации межмолекулярных взаимодействий и ее применения в органических фотоэлектрических модулях большой площади. Доп. Энергия Матер. 6:1600228. doi: 10.1002/aenm.201600228
CrossRef Полный текст | Google Scholar
Beaujuge, PM, and Frechet, JMJ (2011). Молекулярный дизайн и эффекты упорядочения в пи-функциональных материалах для применения в транзисторах и солнечных элементах. Дж. Ам. хим. соц. 133, 2009–20029 гг. doi: 10.1021/ja2073643
Дж. Ам. хим. соц. 133, 2009–20029 гг. doi: 10.1021/ja2073643
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Blom, PWM, Tanase, C., de Leeuw, DM, and Coehoorn, R. (2005). Масштабирование толщины тока, ограниченного объемным зарядом, в поли(п-фениленвинилене). Заяв. физ. лат. 86:092105. doi: 10.1063/1.1868865
Полный текст CrossRef | Google Scholar
Брабек С. Дж., Гоурисанкер С., Холлс Дж. Дж. М., Лэрд Д., Цзя С. и Уильямс С. П. (2010). Полимер-фуллереновые солнечные элементы с объемным гетеропереходом. Доп. Матер. 22, 3839–3856. doi: 10.1002/adma.2007
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чен Дж. и Цао Ю. (2009). Разработка новых сопряженных донорных полимеров для высокоэффективных фотоэлектрических устройств с объемным гетеропереходом. Согл. хим. Рез. 42, 1709–1718 гг. doi: 10.1021/ar1z
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ченг П. , Ли Г., Чжан X. и Ян Ю. (2018). Органическая фотовольтаика нового поколения на основе нефуллереновых акцепторов. Нац. Фотон. 12, 131–142. doi: 10.1038/s41566-018-0104-9
, Ли Г., Чжан X. и Ян Ю. (2018). Органическая фотовольтаика нового поколения на основе нефуллереновых акцепторов. Нац. Фотон. 12, 131–142. doi: 10.1038/s41566-018-0104-9
CrossRef Full Text | Google Scholar
Ченг, Ю. Дж., Ян, С. Х., и Хсу, К. С. (2009). Синтез сопряженных полимеров для органических солнечных батарей. Хим. Ред. 109, 5868–5923. doi: 10.1021/cr2s
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Etxebarria, I., Ajuria, J., and Pacios, R. (2015). Полимерные солнечные элементы, пригодные для обработки раствором: обзор материалов, стратегий и архитектур элементов для преодоления 10%. Орган. Электрон. 19, 34–60. doi: 10.1016/j.orgel.2015.01.014
CrossRef Полный текст | Google Scholar
Факкетти, А. (2013). Полимерно-донорно-полимерно-акцепторные (полностью полимерные) солнечные элементы. Матер. Сегодня 16, 123–132. doi: 10.1016/j.mattod.2013.04.005
CrossRef Полный текст | Google Scholar
Форрест, С. Р. (2004). Путь к вездесущим и недорогим органическим электронным приборам на пластике. Природа 428, 911–918. дои: 10.1038/nature02498
Р. (2004). Путь к вездесущим и недорогим органическим электронным приборам на пластике. Природа 428, 911–918. дои: 10.1038/nature02498
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Hartnett, P.E., Timalsina, A., Matte, H.S.S.R., Zhou, N., Guo, X., Zhao, W., et al. (2014). Slip-Stacked перилендиимиды как альтернативная стратегия для высокоэффективных нефуллереновых акцепторов в органических фотогальванических элементах. Дж. Ам. хим. соц. 136, 16345–16356. doi: 10.1021/ja508814z
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хенсон, З. Б., Мюллен, К., и Базан, Г. К. (2012). Стратегии разработки органических полупроводников за пределами молекулярной формулы. Нац. хим. 4, 699–704. doi: 10.1038/nchem.1422
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хоу Дж., Инганас О., Френд Р. Х. и Гао Ф. (2018). Органические солнечные элементы на основе нефуллереновых акцепторов. Нац. Матер. 17, 119–128. doi: 10.1038/nmat5063
Нац. Матер. 17, 119–128. doi: 10.1038/nmat5063
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хуанг Х., Ян Л., Факкетти А. и Маркс Т. Дж. (2017). Органические и полимерные полупроводники, усиленные нековалентными конформационными блокировками. Хим. Ред. 117, 10291–10318. doi: 10.1021/acs.chemrev.7b00084
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Jung, J.W., Jo, J.W., Chueh, C.C., Liu, F., Jo, W.H., Russell, T.P., et al. (2015). Фторзамещенные сопряженные полимеры n-типа для бездобавочных цельнополимерных солнечных элементов с объемным гетеропереходом с высокой эффективностью преобразования энергии 6,71%. Доп. Матер. 27, 3310–3317. doi: 10.1002/adma.201501214
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Ким Х.Г., Канг Б., Ко Х., Ли Дж., Шин Дж. и Чо К. (2015). Синтетическая адаптация твердотельного порядка в сополимерах на основе дикетопирролопиррола посредством внутримолекулярных нековалентных взаимодействий. Хим. Матер. 27, 829–838. doi: 10.1021/cm503864u
Хим. Матер. 27, 829–838. doi: 10.1021/cm503864u
CrossRef Полный текст | Google Scholar
Кумар П. и Чанд С. (2012). Недавний прогресс и будущие аспекты органических солнечных элементов. Прог. Фотогальваника 20, 377–415. doi: 10.1002/pip.1141
Полнотекстовая перекрестная ссылка | Google Scholar
Лей Т., Ся С., Ван Дж. Ю., Лю С. Дж. и Пей Дж. (2014). «Конформационно заблокированные» сильные электронодефицитные производные поли(п-фениленвинилена) для устойчивых к окружающей среде полевых транзисторов n-типа: синтез, свойства и влияние положения замещения фтора. Дж. Ам. хим. соц. 136, 2135–2141. doi: 10.1021/ja412533d
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лэй Ю., Вэньсин Г., Лэй Л., Юшэн К., Юфэй Ю., Пан Ю. и др. (2018). Триплетные акцепторы на основе теллурофена для органических солнечных элементов. Анжю. хим. 130, 1108–1114. doi: 10.1002/ange.201712011
CrossRef Full Text | Google Scholar
Li, H. , Earmme, T., Ren, G., Saeki, A., Yoshikawa, S., Murari, N. M., et al. (2014). Помимо фуллеренов: разработка нефуллереновых акцепторов для эффективной органической фотовольтаики. Дж. Ам. хим. соц. 136, 14589–14597. doi: 10.1021/ja508472j
, Earmme, T., Ren, G., Saeki, A., Yoshikawa, S., Murari, N. M., et al. (2014). Помимо фуллеренов: разработка нефуллереновых акцепторов для эффективной органической фотовольтаики. Дж. Ам. хим. соц. 136, 14589–14597. doi: 10.1021/ja508472j
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ли, Ю. (2012). Молекулярный дизайн фотогальванических материалов для полимерных солнечных элементов: к подходящим уровням электронной энергии и широкому поглощению. Согл. хим. Рез. 45, 723–733. doi: 10.1021/ar2002446
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ли Ю., Цао Ю., Гао Дж., Ван Д., Ю Г. и Хигер А.Дж. (1999). Электрохимические свойства люминесцентных полимеров и полимерных светоизлучающих электрохимических элементов. Синтетические металлы 99, 243–248. doi: 10.1016/S0379-6779(99)00007-7
Полный текст CrossRef | Google Scholar
Ю. Лин, Ю. Ван, Дж. Ван, Дж. Хоу, Ю. Ли, Д. Чжу и др. (2014). Звездообразный перилендиимидный акцептор электронов для высокоэффективных органических солнечных элементов. Доп. Матер. 26, 5137–5142. doi: 10.1002/adma.201400525
(2014). Звездообразный перилендиимидный акцептор электронов для высокоэффективных органических солнечных элементов. Доп. Матер. 26, 5137–5142. doi: 10.1002/adma.201400525
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лин Ю. и Чжан Х. (2016). Олигомерные молекулы для эффективной органической фотовольтаики. Согл. хим. Рез. 49, 175–183. doi: 10.1021/acs.accounts.5b00363
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Линь Ю., Чжан З.-Г., Бай Х., Ван Дж., Яо Ю., Ли Ю. и др. (2015). Высокоэффективные полимерные солнечные элементы без фуллеренов с эффективностью 6,31%. Энергетика Окружающая среда. науч. 8, 610–616. doi: 10.1039/C4EE03424D
Полный текст CrossRef | Google Scholar
Лю Д., Ян Л., Ву Ю., Ван Х., Цзэн Ю., Хань Г. и др. (2018). Настраиваемые свойства донора и акцептора электронов, достигаемые путем модуляции стерических затруднений боковых цепей в низкомолекулярных фотоэлектрических материалах a-d-a. Хим. Матер. 30, 619–628. doi: 10.1021/acs.chemmater.7b03142
Хим. Матер. 30, 619–628. doi: 10.1021/acs.chemmater.7b03142
Полный текст CrossRef | Google Scholar
Liu, Y., Mu, C., Jiang, K., Zhao, J., Li, Y., Zhang, L., et al. (2015). Органические солнечные элементы: небольшой молекулярный акцептор с трехмерной структурой на основе тетрафенилэтилена, позволяющий создавать эффективные нефуллереновые органические солнечные элементы. Доп. Матер. 27, 1014–1014. doi: 10.1002/adma.201570038
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лонг, X., Дин, З., Доу, К., Чжан, Дж., Лю, Дж., и Ван, Л. (2016). Полимерный акцептор на основе звена двойного B < -N-мостикового бипиридина (BNBP) для высокоэффективных цельнополимерных солнечных элементов. Доп. Матер. 28, 6504–6508. doi: 10.1002/adma.201601205
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Прайс С.К., Стюарт А.С., Ян Л., Чжоу Х. и Ю В. (2011). Замещенный фтором сопряженный полимер со средней шириной запрещенной зоны обеспечивает эффективность 7% в полимерно-фуллереновых солнечных элементах. Дж. Ам. хим. соц. 133, 4625–4631. doi: 10.1021/ja1112595
Дж. Ам. хим. соц. 133, 4625–4631. doi: 10.1021/ja1112595
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сакамото Ю., Комацу С. и Судзуки Т. (2001). Тетрадекафторсектиофен: первый перфторированный олиготиофен. Дж. Ам. хим. соц. 123, 4643–4644. doi: 10.1021/ja015712j
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Шарбер, М. К., и Сарисифтчи, Н. С. (2013). Эффективность органических солнечных элементов с объемным гетеропереходом. Прогр. Полим. науч. 38, 1929–1940. doi: 10.1016/j.progpolymsci.2013.05.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Шарбер, М. К., Вульбахер, Д., Коппе, М., Денк, П., Вальдауф, К., Хигер, А. Дж., и др. (2006). Правила проектирования доноров в солнечных элементах с объемным гетеропереходом — к эффективности преобразования энергии 10 %. Доп. Матер. 18, 789–794. doi: 10.1002/adma.200501717
Полный текст CrossRef | Google Scholar
Сунь Д. , Мэн Д., Цай Ю., Фань Б., Ли Ю., Цзян В. и др. (2015). Органические солнечные элементы с объемным гетеропереходом на основе нефуллереновых акцепторов с эффективностью более 7%. Дж. Ам. хим. соц. 137, 11156–11162. doi: 10.1021/jacs.5b06414
, Мэн Д., Цай Ю., Фань Б., Ли Ю., Цзян В. и др. (2015). Органические солнечные элементы с объемным гетеропереходом на основе нефуллереновых акцепторов с эффективностью более 7%. Дж. Ам. хим. соц. 137, 11156–11162. doi: 10.1021/jacs.5b06414
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Томпсон, Б. К., и Фреше, Дж. М. Дж. (2008). Полимерно-фуллереновые композитные солнечные элементы. Анжю. хим. Интер. Эд. 47, 58–77. doi: 10.1002/anie.200702506
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Wienk, M.M., Kroon, J.M., Verhees, WJH, Knol, J., Hummelen, J.C., van Hal, P.A., et al. (2003). эффективные фотоэлектрические элементы с объемным гетеропереходом на основе метано[70]фуллерена/мдмо-ППВ. Анжю. хим. 115, 3493–3497. doi: 10.1002/ange.200351647
CrossRef Full Text | Google Scholar
Ву, К., Денг, Д., Лу, К., и Вэй, З. Х. (2017). D-A структурные белковые низкомолекулярные донорные материалы для органических солнечных элементов, обработанных в растворе. Подбородок. хим. лат. 28, 2065–2077. doi: 10.1016/j.cclet.2017.08.046
Подбородок. хим. лат. 28, 2065–2077. doi: 10.1016/j.cclet.2017.08.046
CrossRef Полный текст | Google Scholar
Ву Ю., Бай Х., Ван З., Ченг П., Чжу С., Ван Ю. и др. (2015). Планарный акцептор электронов для эффективных полимерных солнечных элементов. Энергетика Окружающая среда. науч. 8, 3215–3221. doi: 10.1039/C5EE02477C
CrossRef Полный текст | Google Scholar
Сюй Т. и Ю Л. (2014). Как разработать полимеры с узкой запрещенной зоной для высокоэффективных органических солнечных элементов. Матер. Сегодня 17, 11–15. doi: 10.1016/j.mattod.2013.12.005
CrossRef Полный текст | Google Scholar
Ян Л., Чен Ю., Чен С., Донг Т., Дэн В., Лв Л. и др. (2016). Достижение высокой производительности нефуллереновых органических солнечных элементов за счет настройки количества электронно-дефицитных строительных блоков молекулярных акцепторов. Дж. Пауэр Сауэр. 324, 538–546. doi: 10.1016/j.jpowsour.2016.05.119
CrossRef Full Text | Google Scholar
Ю С. , Чен Ю., Ян Л., Е П., Ву Дж., Ю Дж. и др. (2017). Значительное улучшение фотоэлектрических характеристик за счет введения конформационных замков S?N. Дж. Матер. хим. А 5, 21674–21678. doi: 10.1039/C7TA05774A
, Чен Ю., Ян Л., Е П., Ву Дж., Ю Дж. и др. (2017). Значительное улучшение фотоэлектрических характеристик за счет введения конформационных замков S?N. Дж. Матер. хим. А 5, 21674–21678. doi: 10.1039/C7TA05774A
CrossRef Полный текст | Google Scholar
Юань Л., Лу К., Ся Б., Чжан Дж., Ван З., Ван З. и др. (2016). Акцепторные концевые олигомерные сопряженные молекулы с расширенным поглощением и повышенными коэффициентами экстинкции для высокоэффективных органических солнечных элементов. Доп. Матер. 28, 5980–5985. doi: 10.1002/adma.201600512
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чжан Х., Е Л. и Хоу Дж. (2015). Стратегии молекулярного дизайна для модуляции напряжения в высокоэффективных полимерных солнечных элементах. Полим. Междунар. 64, 957–962. doi: 10.1002/pi.4895
CrossRef Полный текст | Google Scholar
Zhang, Q., Kan, B., Liu, F., Long, G., Wan, X., Chen, X., et al. (2015). Низкомолекулярные солнечные элементы с эффективностью более 9%. Нац. Фотон. 9, 35–41. doi: 10.1038/nphoton.2014.269
Нац. Фотон. 9, 35–41. doi: 10.1038/nphoton.2014.269
CrossRef Полный текст | Google Scholar
Чжан, К., Келли, М.А., Бауэр, Н., и Ю, В. (2017). Курьезный случай фторирования сопряженных полимеров для солнечных элементов. Согл. хим. Рез. 50, 2401–2409. doi: 10.1021/acs.accounts.7b00326
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Zhang X., Lu Z., Ye L., Zhan C., Hou J., Zhang S. и др. (2013). Потенциальный акцепторный материал на основе димера перилендиимида для высокоэффективных нефуллереновых органических солнечных элементов, обработанных раствором, с эффективностью 4,03%. Доп. Матер. 25, 5791–5797. doi: 10.1002/adma.201300897
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чжао В., Ли С., Яо Х., Чжан С., Чжан Ю., Ян Б. и др. (2017). Молекулярная оптимизация обеспечивает эффективность органических солнечных элементов более 13%. Дж. Ам. хим. соц. 139, 7148–7151. doi: 10.1021/jacs.7b02677
doi: 10.1021/jacs.7b02677
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чжао В., Цянь Д., Чжан С., Ли С., Инганас О., Гао Ф. и др. (2016). Полимерные солнечные элементы без фуллеренов с эффективностью более 11% и превосходной термостабильностью. Доп. Матер. 28, 4734–4739. doi: 10.1002/adma.201600281
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чжоу Х., Ян Л., Стюарт А.С., Прайс С.К., Лю С. и Ю В. (2011). Разработка фторированного бензотиадиазола как структурного элемента полимерного солнечного элемента с эффективностью 7 %. Анжю. хим. Интер. Эд. 50, 2995–2998. doi: 10.1002/anie.201005451
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Zhu, X.W., Lu, K., Li, H., Zhou, R.M., and Wei, Z.X. (2016). Донорные материалы на основе нафтодитиофена для органических солнечных элементов, обработанных раствором. Чин. хим. лат. 27, 1271–1276. doi: 10.1016/j. cclet.2016.06.015
cclet.2016.06.015
CrossRef Полный текст | Google Scholar
Электронодонорно-акцепторные комплексы (EDA) в фотохимии
Фотохимия электронодонорно-акцепторных (EDA) комплексов предоставляет новую возможность для создания сложных химических структур (скаффолдов) без необходимости использования дорогих фотокатализаторов, таких как иридий или рутений. С недавней публикацией Паоло Мельхиорре и соавторов углубленного открытого обзора «Синтетические методы, управляемые фотоактивностью электронодонорно-акцепторных комплексов» в JACS J. Am. хим. соц. (2020) 142(12):5461-5476 ( Ref 1 ), мы подумали, что это прекрасная возможность обсудить современные фотохимические подходы с использованием химии доноров-акцепторов электронов в синтетических схемах по сравнению с более распространенной химией фоторедокса или металлоредокса ( Ref 2 ).
Недавний всплеск интереса к синтетическим методам в фотохимии был вызван фотоокислительно-восстановительным катализом, процессом, в котором фотокатализатор использует энергию видимого света для запуска реакции между двумя субстратами, которая иначе не протекала бы ( Ссылка 3,4 ). Во многих случаях возбужденное состояние фотокатализатора может действовать как окислитель и как восстановитель по мере необходимости, передавая или получая электрон в соответствующее время ( Рисунок 1 ). Это общая схема реакции, обеспечивающая множество фотоокислительно-восстановительных или металлофотоокислительно-каталитических реакций, управляемых рутениевыми и иридиевыми фотокатализаторами, которые стали преобладать в последнее десятилетие.
Во многих случаях возбужденное состояние фотокатализатора может действовать как окислитель и как восстановитель по мере необходимости, передавая или получая электрон в соответствующее время ( Рисунок 1 ). Это общая схема реакции, обеспечивающая множество фотоокислительно-восстановительных или металлофотоокислительно-каталитических реакций, управляемых рутениевыми и иридиевыми фотокатализаторами, которые стали преобладать в последнее десятилетие.
Рис. 1. Общая роль возбужденного фотокатализатора как окислителя и восстановителя в фотоокислительно-восстановительном катализе
В отличие от фотоокислительно-восстановительного катализа, фотоактивные донорно-акцепторные комплексы электронов не требуют фотокатализатора ( Рисунок 2 ). Донор электронов (D) и акцептор (A), которые часто не поглощают свет по отдельности, при комплексообразовании могут поглощать видимый свет, претерпевая перенос одного электрона с образованием промежуточных радикалов. Этот подход дает возможность генерировать радикалы (D+, A-) из субстратов, которые обычно не поглощают видимый спектр. Задача с синтетической точки зрения состоит в том, чтобы избежать обратного переноса электрона реакции, непродуктивно образующей два мономера в их основном состоянии. Возрождение методов синтеза доноров-акцепторов электронов как области фотохимии произошло в результате двух независимых наблюдений в 2013 году группой Чатани с фоторедоксом ( Ref 5 ) и группой Мельхиорре, изучающей органокатализ ( Ref 6 ). Контрольные эксперименты для конкретных комбинаций субстратов в присутствии света проводились в отсутствие катализатора.
Этот подход дает возможность генерировать радикалы (D+, A-) из субстратов, которые обычно не поглощают видимый спектр. Задача с синтетической точки зрения состоит в том, чтобы избежать обратного переноса электрона реакции, непродуктивно образующей два мономера в их основном состоянии. Возрождение методов синтеза доноров-акцепторов электронов как области фотохимии произошло в результате двух независимых наблюдений в 2013 году группой Чатани с фоторедоксом ( Ref 5 ) и группой Мельхиорре, изучающей органокатализ ( Ref 6 ). Контрольные эксперименты для конкретных комбинаций субстратов в присутствии света проводились в отсутствие катализатора.
Рисунок 2: Общая стратегия фотоактивности электронодонорных комплексов
Прямое связывание электронодонорно-акцепторных комплексов EDA
Наиболее простым подходом к комплексам EDA является прямое связывание двух компонентов при активации светом. В этом подходе жизнеспособность реакции присуща электронным свойствам двух партнеров и образующихся радикалов. Одна из распространенных стратегий включает подходящую уходящую группу в донорно-акцепторном комплексе электронов, чтобы инициировать необратимую фрагментацию, превосходящую обратный перенос электронов (9).0322 Рисунок 3A ). Большинство примеров в этом классе связаны с образованием связи C-C с несколькими специализированными примерами образования связи C-S (см. Таблицу ниже).
Одна из распространенных стратегий включает подходящую уходящую группу в донорно-акцепторном комплексе электронов, чтобы инициировать необратимую фрагментацию, превосходящую обратный перенос электронов (9).0322 Рисунок 3A ). Большинство примеров в этом классе связаны с образованием связи C-C с несколькими специализированными примерами образования связи C-S (см. Таблицу ниже).
Ограничением этого подхода является потребность в высокополярных донорных и акцепторных молекулах, которые в конечном итоге попадают в продукт. С другой стороны, жертвуемый донор можно использовать для образования комплекса EDA, который при возбуждении образует радикальное промежуточное соединение, подходящее для реакции с ловушкой радикалов (, рис. 3B, ). Если уходящая группа также может выступать в качестве окислительно-восстановительного вспомогательного вещества, то синтетический диапазон потенциальных реагентов может значительно расшириться (9).0322 Фигура 3C ). Использование окислительно-восстановительного вспомогательного вещества позволяет подходящему полярному акцептору образовывать комплекс EDA, но генерирует радикал при потере окислительно-восстановительного вспомогательного вещества, который не подвергается смещению за счет внутренней стабилизации или активации в молекуле. Универсальные окислительно-восстановительные вспомогательные вещества, которые можно легко добавлять и удалять из желаемых реагентов, потенциально могут позволить синтетические платформы для широкого использования комплексов EDA донор-акцептор электронов.
Универсальные окислительно-восстановительные вспомогательные вещества, которые можно легко добавлять и удалять из желаемых реагентов, потенциально могут позволить синтетические платформы для широкого использования комплексов EDA донор-акцептор электронов.
Рисунок 3: Стратегии использования фотоактивации избирательных донорно-акцепторных комплексов
Несколько примеров общих компонентов для донорских комплексов электронов показаны на рисунке 4.
Рисунок 4: Репрезентативные фотоактивные комплексы донорных электронов
| Донор | Акцептор | Ловушка для радикалов | Продукт | |
| ЭДА со встроенным выходом (ссылка 7) | ||||
| ЭДА со встроенным выходом (ссылка 5) | ||||
| Жертвенный донор (ссылка 8) | ||||
| Жертвенный донор Редокс вспомогательный (ссылка 9) | ||||
| Жертвенный донор, вспомогательная ловушка радикалов Redox (ссылка 10) |
Фотоактивность каталитических комплексов ЭДА
Чтобы избежать использования стехиометрических реагентов, важным подходом в этой области является образование комплекса ЭДА в каталитическом цикле. В этом подходе катализатор активирует один из субстратов (слабополярный) в более полярную форму, вызывая образование комплекса ЭДА, который затем может быть фотоактивным. Этот тип реакционной способности дает возможность асимметричного катализа с хиральным катализатором. В этой схеме слабый донор взаимодействует с органическим катализатором.
В этом подходе катализатор активирует один из субстратов (слабополярный) в более полярную форму, вызывая образование комплекса ЭДА, который затем может быть фотоактивным. Этот тип реакционной способности дает возможность асимметричного катализа с хиральным катализатором. В этой схеме слабый донор взаимодействует с органическим катализатором.
Рисунок 5: Комплекс катализатор-донор управляет образованием EDA и инициирует каталитический цикл предварительный катализатор, этот обзор демонстрирует синтетическую полезность этого захватывающего поля.
Таким образом, новые окислительно-восстановительные вспомогательные вещества, хиральные лиганды и новые реакции потенциально могут обеспечить новый подход к созданию библиотек медицинской химии, созданных с помощью фотохимии.
Фотохимические реакции протекают в мягких условиях с высокой толерантностью к функциональным группам и могут быть применимы к широкому спектру синтетической химии. С недавними достижениями и дискуссиями о процессе «фотонных эквивалентов» (обработка света как контролируемого реагента в синтезе) не должно быть никаких ограничений для объема и масштаба фотохимических стратегий, обсуждаемых здесь, и их использования в химическом производстве ( Ref 11 ) . Мы надеемся, что вы ознакомитесь с обзором, чтобы узнать об исторической перспективе, полезности и будущих проблемах этого очень ценного синтетического подхода к манипулированию радикальной химией.
Мы надеемся, что вы ознакомитесь с обзором, чтобы узнать об исторической перспективе, полезности и будущих проблемах этого очень ценного синтетического подхода к манипулированию радикальной химией.
Ссылки:
(1) Giacomo E.M. Crisenza, Daniele Mazzarella, Paolo Melchiorre, Синтетические методы, основанные на фотоактивности электронодонорно-акцепторных комплексов, J. Am. хим. соц. 2020, 142, 12, 5461-5476. (https://pubs.acs.org/doi/10.1021/jacs.0c01416)
(2) Шоу, М. Х.; Твилтон, Дж.; Макмиллан, Д. В. К. Фотоокислительно-восстановительный катализ в органической химии. Дж. Орг. хим. 2016, 81, 6898−6926. https://pubs.acs.org/doi/abs/10.1021/acs.joc.6b01449
(3) Марзо, Л.; Пагире, СК; Райзер, О .; Кениг, Б. Фотокатализ в видимом свете: имеет ли он значение для органического синтеза? Ангью. хим., межд. Эд. 2018, 57, 10034−10072. https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.201709766
(4) Рори К. Макэти, Эдвард Дж. Макклейн, Р.Дж. Стефенсон, Освещение фотоокислительно-восстановительного катализа, Тенденции в химии, 1, 1 P111-125. https://www.cell.com/trends/chemistry/fulltext/S2589-5974(19)30009-7
https://www.cell.com/trends/chemistry/fulltext/S2589-5974(19)30009-7
(5) Тобису, М.; Фурукава, Т .; Чатани, Н. Опосредованное видимым светом прямое арилирование аренов и гетероаренов с использованием солей диарилиодония в присутствии и в отсутствие фотокатализатора. хим. лат. 2013, 42, 1203−1205. https://www.journal.csj.jp/doi/abs/10.1246/cl.130547
(6) Арсео, Э.; Юрберг, И. Д.; Альварес-Фернандес, А .; Мельхиорре, П. Фотохимическая активность ключевого донорно-акцепторного комплекса может управлять стереоселективным каталитическим α-алкилированием альдегидов. Нац. хим. 2013, 5, 750-756. https://www.nature.com/articles/nchem.1727
(7) Кандукури, С.Р.; Бахамонде, А .; Чаттерджи, И.; Юрберг, И. Д.; Эскудеро-Адан, EC; Мельхиорре, П. Рентгеновская характеристика комплекса донор-акцептор электронов, управляющего фотохимическим алкилированием индолов. Ангью. хим., межд. Эд. 2015, 54, 1485−1489. https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.201409529
(8) Sun, X. ; Ван, В .; Ли, Ю .; Ма, Дж.; Ю, С. Промотируемая галогенной связью двойная радикальная изоцианидная вставка под действием видимого света: синтез 2-фторалкилированных хиноксалинов. Орг. лат. 2016, 18, 4638−4641. https://pubs.acs.org/doi/10.1021/acs.orglett.6b02271
; Ван, В .; Ли, Ю .; Ма, Дж.; Ю, С. Промотируемая галогенной связью двойная радикальная изоцианидная вставка под действием видимого света: синтез 2-фторалкилированных хиноксалинов. Орг. лат. 2016, 18, 4638−4641. https://pubs.acs.org/doi/10.1021/acs.orglett.6b02271
(9) Дэвис, Дж.; Бут, С.Г.; Эссафи, С.; Dryfe, RAW; Леонори, Д. Опосредованное видимым светом образование азотцентрированных радикалов: реакции циклизации безметаллового гидроаминирования и аминогидроксилирования. Ангью. хим., межд. Эд. 2015, 54, 14017−14021 https://onlinelibrary.wiley.com/doi/full/10.1002/anie.201507641
(10) Zhang, J.; Ли, Ю .; Сюй, Р .; Chen, Y. Донорно-акцепторный комплекс обеспечивает генерацию алкоксильных радикалов для безметаллового расщепления C(sp3)-C(sp3) и аллилирования/алкенилирования. Ангью. хим., межд. Эд. 2017, 56, 12619−12623. https://pubmed.ncbi.nlm.nih.gov/28809077/
(11) Эмили Б. Коркоран, Джонатан П. Макмаллен, Франсуа Левеск, Майкл К. Висмер и Джон Р. Набер Фотонные эквиваленты как параметр для масштабирования Фотоокислительно-восстановительные реакции в потоке: перевод фотокаталитического перекрестного взаимодействия C-N с лабораторного масштаба на многокилограммовый масштаб Angew. Хим. Интерн. Эд. 2020, Онлайн. https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.201915412
Хим. Интерн. Эд. 2020, Онлайн. https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.201915412
Фотокатализ в морской воде
Морская вода: она обильная, грязная, содержит соли, микроорганизмы, биомассу, органические и неорганические загрязнители (и микропластик) и может просто быть отличным растворителем для получения перекиси водорода с помощью фотокатализа в видимом свете
Подробнее
Свяжитесь с нами
Электронодонорно-акцепторные комплексы | Молекулы и модели: молекулярные структуры соединений элементов основной группы
Фильтр поиска панели навигации Oxford AcademicMolecules and Models: молекулярные структуры соединений основных групп элементовАтомная, молекулярная и оптическая физикаФизика конденсированного состоянияКнигиЖурналы Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Oxford AcademicMolecules and Models: молекулярные структуры соединений основных групп элементовАтомная, молекулярная и оптическая физикаФизика конденсированного состоянияКнигиЖурналы Термин поиска на микросайте
Расширенный поиск
Иконка Цитировать Цитировать
Разрешения
- Делиться
- Твиттер
- Подробнее
Ссылка
Haaland, Arne,
‘Electron donor–acceptor complexes’
,
Molecules and Models: The molecular structures of main group element compounds
(
Oxford,
2008;
online edn,
Oxford Academic
, 1 мая 2008 г.
), https://doi.org/10.1093/acprof:oso/9780199235353.003.0016,
, по состоянию на 24 сентября 2022 г.
Выберите формат Выберите format.ris (Mendeley, Papers, Zotero).enw (EndNote).bibtex (BibTex).txt (Medlars, RefWorks)
Закрыть
Фильтр поиска панели навигации Oxford AcademicMolecules and Models: молекулярные структуры соединений основных групп элементовАтомная, молекулярная и оптическая физикаФизика конденсированного состоянияКнигиЖурналы Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Oxford AcademicMolecules and Models: молекулярные структуры соединений основных групп элементовАтомная, молекулярная и оптическая физикаФизика конденсированного состоянияКнигиЖурналы Термин поиска на микросайте
Advanced Search
Abstract
Глава начинается со сравнения длин связей, энергий связи и электрических дипольных моментов этана и аминоборана. Минимально энергетический разрыв ковалентной связи СС в этане протекает гомолитически с образованием двух метильных радикалов. Разрыв связи NB с минимальной энергией в H 3 NBH 3 протекает гетеролитически с образованием двух молекул с замкнутой оболочкой (H 3 N и BH 3 ). Такие связи называются дативными или электронно-донорно-акцепторными связями. Дательные связи длиннее и слабее, чем ковалентная связь между теми же атомами, и более чувствительны к индуктивным эффектам или изменению фазы. Описаны структуры и энергии связи ряда комплексов с донорными атомами N, P, O или S и акцепторными атомами B, Al, Be, Zn, Si, As, Sb. Обсуждаются кольцевые или каркасные соединения с дательным падежом. Наконец, дательный падеж π-связи в аминоборане (H 2 NBH 2 ) и боразин (B 3 N 3 H 6 ).
Минимально энергетический разрыв ковалентной связи СС в этане протекает гомолитически с образованием двух метильных радикалов. Разрыв связи NB с минимальной энергией в H 3 NBH 3 протекает гетеролитически с образованием двух молекул с замкнутой оболочкой (H 3 N и BH 3 ). Такие связи называются дативными или электронно-донорно-акцепторными связями. Дательные связи длиннее и слабее, чем ковалентная связь между теми же атомами, и более чувствительны к индуктивным эффектам или изменению фазы. Описаны структуры и энергии связи ряда комплексов с донорными атомами N, P, O или S и акцепторными атомами B, Al, Be, Zn, Si, As, Sb. Обсуждаются кольцевые или каркасные соединения с дательным падежом. Наконец, дательный падеж π-связи в аминоборане (H 2 NBH 2 ) и боразин (B 3 N 3 H 6 ).
Ключевые слова: дательные связи, аминоборан, индукционные эффекты, эффекты фазового перехода, модель ВСЕПР, комплексы алюминия, сурьма, кольца, клетки, дательная π-связь
Предмет
Физика конденсированного состояния Атомная, молекулярная и оптическая физика
В настоящее время у вас нет доступа к этой главе.
Войти
Получить помощь с доступом
Получить помощь с доступом
Доступ для учреждений
Доступ к контенту в Oxford Academic часто предоставляется посредством институциональных подписок и покупок. Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Доступ на основе IP
Как правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с IP-аутентификацией.
Войдите через свое учреждение
Выберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения. Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
- Нажмите Войти через свое учреждение.
- Выберите свое учреждение из предоставленного списка, после чего вы перейдете на веб-сайт вашего учреждения для входа.
- Находясь на сайте учреждения, используйте учетные данные, предоставленные вашим учреждением. Не используйте личную учетную запись Oxford Academic.
- После успешного входа вы вернетесь в Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору.
Войти с помощью читательского билета
Введите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Члены общества
Доступ члена общества к журналу достигается одним из следующих способов:
Войти через сайт сообщества
Многие общества предлагают единый вход между веб-сайтом общества и Oxford Academic. Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
- Нажмите Войти через сайт сообщества.
- При посещении сайта общества используйте учетные данные, предоставленные этим обществом. Не используйте личную учетную запись Oxford Academic.
- После успешного входа вы вернетесь в Oxford Academic.
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество.
Вход через личный кабинет
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам. Смотри ниже.
Личный кабинет
Личную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок.
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам.
Просмотр учетных записей, вошедших в систему
Щелкните значок учетной записи в правом верхнем углу, чтобы:
- Просмотр вашей личной учетной записи, в которой выполнен вход, и доступ к функциям управления учетной записью.
- Просмотр институциональных учетных записей, предоставляющих доступ.
Выполнен вход, но нет доступа к содержимому
Oxford Academic предлагает широкий ассортимент продукции. Подписка учреждения может не распространяться на контент, к которому вы пытаетесь получить доступ. Если вы считаете, что у вас должен быть доступ к этому контенту, обратитесь к своему библиотекарю.
Ведение счетов организаций
Для библиотекарей и администраторов ваша личная учетная запись также предоставляет доступ к управлению институциональной учетной записью. Здесь вы найдете параметры для просмотра и активации подписок, управления институциональными настройками и параметрами доступа, доступа к статистике использования и т. д.
д.
Покупка
Наши книги можно приобрести по подписке или купить в библиотеках и учреждениях.
Информация о покупке
Разница между донорными и акцепторными примесями
Ключевое различие между донорными и акцепторными примесями заключается в том, что элементы группы V периодической таблицы обычно действуют как донорные примеси, тогда как элементы группы III обычно действуют как акцепторные примеси.
Легирование — это процесс добавления примесей в полупроводник. Легирование важно для увеличения проводимости полупроводника. Существует две основные формы легирования: донорное и акцепторное. Донорное легирование добавляет примеси к донору, тогда как акцепторное легирование добавляет примеси к акцептору.
СОДЕРЖАНИЕ
1. Обзор и основные различия
2. Что такое донорные примеси
3. Что такое акцепторные примеси
4. Сравнение бок о бок – донорные и акцепторные примеси в табличной форме
5. Резюме
Резюме
Донорные примеси — это элементы, добавляемые к донору для увеличения электропроводности этого донора. Элементы группы V периодической таблицы являются обычными донорными примесями. Донор — это атом или группа атомов, которые могут образовывать области n-типа при добавлении к полупроводнику. Типичным примером является кремний (Si).
Рис. 1: Наличие донора в силиконовой решетке
Элементы группы V, которые часто служат донорными примесями, включают мышьяк (As), фосфор (P), висмут (Bi) и сурьму (Sb). Эти элементы имеют пять электронов на самой внешней электронной оболочке (есть пять валентных электронов). При добавлении одного из этих атомов к донору, такому как кремний, примесь замещает атом кремния, образуя четыре ковалентные связи. Но теперь есть свободный электрон, так как было пять валентных электронов. Поэтому этот электрон остается свободным, что увеличивает проводимость полупроводника. Кроме того, количество примесных атомов определяет количество свободных электронов, присутствующих в доноре.
Что такое акцепторные примеси?
Акцепторные примеси — это элементы, добавляемые к акцептору для увеличения электропроводности этого акцептора. Элементы группы III распространены как акцепторные примеси. К элементам III группы относятся алюминий (Al), бор (B) и галлий (Ga). Акцептор — это легирующая примесь, которая образует области р-типа при добавлении в полупроводник. Эти атомы имеют три валентных электрона на своих внешних электронных оболочках.
Рис. 2. Наличие акцептора в кремниевой решетке
При добавлении одного из примесных атомов, таких как алюминий, к акцептору он заменяет атомы кремния в полупроводнике. Перед этим добавлением атом кремния имеет вокруг себя четыре ковалентные связи. Когда алюминий занимает положение кремния, атом алюминия образует только три ковалентные связи, что, в свою очередь, приводит к отсутствию ковалентной связи. Это создает свободную точку или отверстие. Однако эти отверстия полезны для проведения электричества. Когда количество добавленных примесных атомов увеличивается, количество дырок, присутствующих в полупроводнике, также увеличивается. Это дополнение, в свою очередь, увеличивает проводимость. После завершения процесса легирования полупроводник становится внешним полупроводником.
Когда количество добавленных примесных атомов увеличивается, количество дырок, присутствующих в полупроводнике, также увеличивается. Это дополнение, в свою очередь, увеличивает проводимость. После завершения процесса легирования полупроводник становится внешним полупроводником.
В чем разница между донорными и акцепторными примесями?
Донорные и акцепторные примеси | |
| Донорные примеси – это элементы, добавляемые к донору для увеличения электропроводности этого донора. | Акцепторные примеси – это элементы, добавляемые к акцептору для увеличения электропроводности этого акцептора. |
| Общие примеси | |
| Элементы группы V | Элементы группы III |
| Примеры примесей | |
| Мышьяк (As), фосфор (P), висмут (Bi) и сурьма (Sb). | Алюминий (Al), бор (B) и галлий (Ga) |
| Процесс | |
Увеличение количества свободных электронов в полупроводнике. | Увеличьте количество отверстий в полупроводнике. |
| Валентные электроны | |
| Атомы имеют пять валентных электронов. | Атомы имеют три валентных электрона. |
| Ковалентная связь | |
| Образует четыре ковалентные связи внутри полупроводника, оставляя пятый электрон свободным. | Образует три ковалентные связи внутри полупроводника, оставляя дыру там, где отсутствует ковалентная связь. |
Резюме – Донорные и акцепторные примеси
Полупроводники – это материалы, проводящие между изолятором, который не является проводником, и металлом, который является проводником. Доноры и акцепторы — это легирующие примеси, образующие проводящие области в полупроводниках. Легирование донора и акцептора — это процессы, повышающие электропроводность полупроводника. Ключевое различие между донорными и акцепторными примесями заключается в том, что элементы группы III периодической таблицы действуют как донорные примеси, тогда как элементы группы V действуют как акцепторные примеси.



 Ниже показана кристаллическая
решётка алмаза.
Ниже показана кристаллическая
решётка алмаза.


