Донорно-акцепторный механизм — это что такое? :: SYL.ru
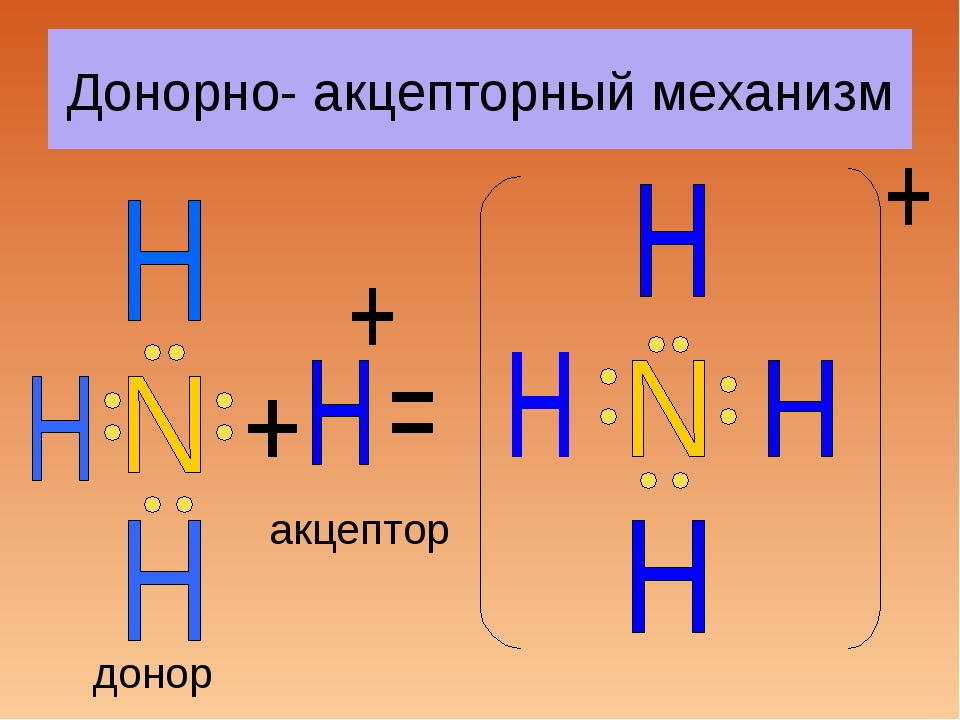
Донорно-акцепторный механизм образования химической связи предполагает перенос заряда между акцептором и донором без создания между ними общей химической связи. Также возможна передача неподеленной пары электронов к акцептору от донора, в результате образуется связь.
Образование солей аммония
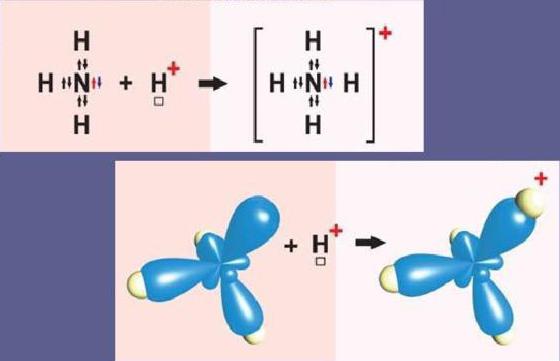
Рассмотрим донорно-акцепторный механизм на примере солей аммония. Начнем со взаимодействия аммиака (Nh4) и трифторида бора (BF3). В процессе реакции происходит выделение 171,4 кДж/моль энергии. Взаимодействие протекает по уравнению:
NH3 + BF3 = NH3BF3
Из четырех орбиталей, имеющихся у атома бора, три заполнены электронами, следовательно, есть одна вакантная орбиталь. В молекуле аммиака четыре орбитали азота укомплектованы электронами, причем три из них по обменному механизму дополнены электронами водорода. Одна орбиталь имеет электронную пару, принадлежащую только атому азота. Ее называют неподеленной электронной парой. Именно благодаря ей возможен донорно-акцепторный механизм.
Соединение между аммиаком и трифторидом бора возможно благодаря тому, что вакантная электронная пара аммиака размещается на свободной орбитали фторида бора.
Это донорно-акцепторный механизм образования ковалентной связи. Атом азота увеличивает валентность благодаря использованию неподеленной пары электронов для дополнительной связи. Бор повышает валентность посредством расположения на орбитали дополнительных электронов.
Таким образом, валентность этих химических элементов характеризуется и неспаренными электронами, и неподеленными электронными парами, и свободными орбиталями на внешнем энергетическом уровне.
Определения
Донором в данном примере выступает атом азота, который отдает свою электронную пару на образование химической связи. Акцептором является бор, обладающий вакантной орбиталью, принимающий электронную пару.
Процесс сопровождается уменьшением потенциальной энергии данной системы, выделением эквивалентного количества энергии. Вопросы, касающиеся механизма образования данного вида ковалентной связи, включены в курс школьной программы по химии, они предлагаются в итоговых тестах выпускникам средней общеобразовательной школы.
Образование катиона аммония
Ковалентная связь, образованная по донорно акцепторному механизму, характерна для солей аммония. Остановимся подробнее на ее особенностях. Итак, именно по донорно-акцепторному механизму образована связь между атомами азота и водорода в реакции:
NH3 + H+= NH4+
В качестве акцептора выступает пустая орбиталь катиона водорода. Азот в катионе аммония проявляет валентность 4. Образование связи происходит и благодаря паре электронов, которые до начала взаимодействия принадлежали азоту.
Это связь ковалентная по донорно-акцепторному механизму. В итоге взаимодействия образуется катион аммония, который по ионному механизму будет объединяться с анионами, содержащимися в кислотах.

Образование угарного газа
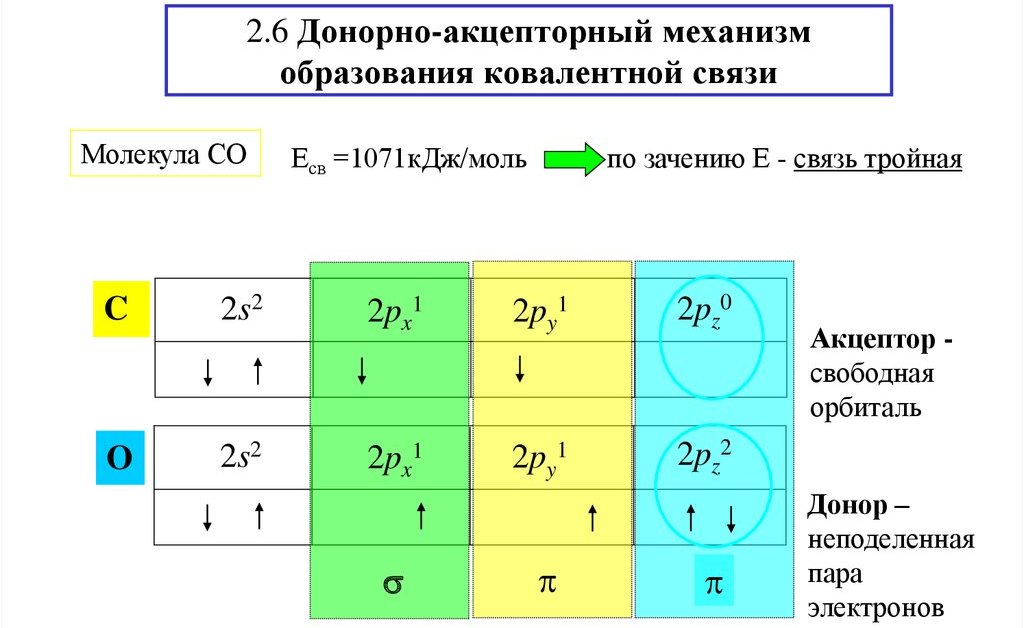
Донорно-акцепторный механизм можно рассмотреть на примере молекулы СО. У атома углерода на внешнем энергетическом уровне располагаются два неспаренных электрона. Такое же количество неспаренных электронов есть и у атома кислорода. В результате между атомами образуется двойная связь.
За счет пары электронов кислорода и пустой орбитали углерода, для получения связи используется донорно-акцепторный механизм.
Молекула азотной кислоты
Благодаря наличию трех неспаренных электронов атом азота в данном соединении образует три варианта связей: с кислородом двойную, одинарную с кислородом гидроксильной группы. По донорно-акцепторному механизму образована связь между еще одним атомом кислорода и азота.
Неспаренные электроны размещаются на одной орбитали, при этом одна освобождается.
Также можно допустить, что атомом азота отдан кислороду электрон. Превратившись в катион аммония, имеющий 4 неспаренные электрона, он удерживает анион благодаря силам электростатического взаимодействия.
Свойства связи
В качестве донора выступают молекулы, в составе которых есть атомы N, O, F, Cl, связанные с атомами иных химических элементов. Акцептором выступает частица, имеющая вакантные электронные уровни. К примеру, это могут быть представители d-семейств, которые имеют незаполненные d-орбитали.
В молекуле аммиака для образования связи задействованы три неспаренных электрона атома азота, и по 1s-электрону у трех атомов водорода. Связи находятся вдоль трех осей р-орбиталей. Молекула имеет вариант правильной пирамиды, в углах которой располагаются атомы водорода, а в вершине — азот азота. Угол между связями составляет 107 градусов. Аналогичные по форме молекулы образуют с водородом следующие элементы: сурьма, мышьяк, фосфор.
Свойства ковалентной связи, которая образуется по донорно-акцепторному механизму, не отличаются от характеристик связи, сформированной по обменному механизму. В качестве доноров могут выступать атомы азота, серы, фосфора, кислорода, владеющие неподеленными электронными парами на валентных орбиталях небольшого размера.
Функцию акцептора выполняют катионы водорода, часть р-металлов, к примеру, алюминий, образуя ион AlH4—.
Также акцепторами выступают d-элементы, у которых есть незаполненная энергетическая ячейка во внешнем электронном слое.
Отметим, что на данный механизм образования связи распространяются все основные характеристики: насыщаемость, длина, кратность.
Особенности органических соединений
Взаимодействие по обменному механизму возможно для органических доноров. В частности, среди них можно отметить π-доноров, типичным примером которых является тетракис(диметиламино)этилене (ТДАЭ), органические акцепторы (фуллерены), хинодиметаны с акцепторными заместителями.
При химическом взаимодействии подобных соединений создается комплекс с переносом заряда. В нем заряженный положительно донор с отрицательно заряженным акцептором взаимодействуют благодаря силам электростатической природы. Значение имеют системы, в которых перенос заряда в основном электронном состоянии происходит частично, а в случае фото возбуждения наблюдается полная его передача.
Такие системы, донорно-акцепторные диады, триады, внутри которых между акцептором и донором есть мостиковая группа, позволяющая повышать длительность состояния с переносом электрического заряда, применяются для получения устройств, преобразующих солнечную энергию. Подобное явление, связанное с переносом заряда в любых его формах, применяется во многих биологических процессах.
Именно поэтому так подробно рассматриваются особенности протекания взаимодействий по донорно-акцепторному механизму в органических соединениях, анализируются возможности ускорения (замедления) подобных процессов, варианты введения дополнительных веществ (катализаторов).
Подведем некоторые итоги
Донорно-акцепторное взаимодействие является одним из важнейших проявлений ковалентной полярной химической связи. Ему уделяется существенное внимание в неорганической, аналитической, органической химии.
К примеру, именно с точки зрения донорно-акцепторного механизма поясняется образование ковалентных локализованных связей в молекулярных ионах координационных (комплексных) соединений. Связь в них создается благодаря неподеленной паре электронов лиганда и свободной орбитали комплексообразователя. Также донорно-акцепторный механизм поясняет формирование промежуточных продуктов. В частности, это создание комплексов с переносом заряда.
Существует модель донорно-акцепторного механизма лишь в рамках представлений о валентности как о возможности локализации плотности электронов в процессе формирования ковалентных связей. Именно этот механизм является основой образования разнообразных комплексных соединений. Такое взаимодействие необходимо для кислотно-основных превращений, касающихся переноса иона водорода (акцептора), образования наноструктур.
примеры. Что такое донорно-акцепторный механизм?
Химической связью называется связь двух и более атомов (молекул) в органическом или неорганическом соединении. Она образуется при условии уменьшения общей энергии в системе.
Все ли элементы могут образовывать химические связи
Все элементы периодической системы имеют разную способность к образованию связи. Наиболее устойчивыми и, как результат, химически малоактивными являются атомы благородных (инертных) газов, так как содержат на внешней электронной оболочке два или восемь электронов. Они образуют небольшое количество связей. К примеру, неон, гелий и аргон не образуют химических связей ни с одним элементом, тогда как ксенон, криптон и радон способны реагировать с фтором и молекулами воды.
У атомов других элементов внешние уровни не завершены и имеют от одного до семи электронов, поэтому для повышения устойчивости оболочки образуют химические связи.
Типы химической связи
Выделяют несколько типов связи:
- Ковалентная.
- Ионная.
- Металлическая.
- Водородная.
Ковалентная связь
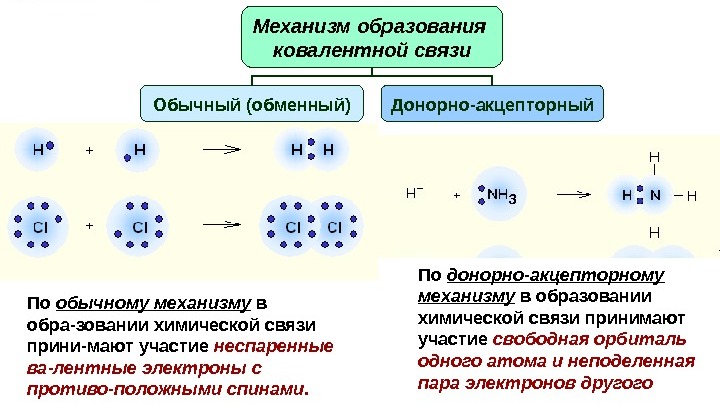
Данный тип связи формируется между атомами в молекуле в результате обобществления или перекрытия валентной электронной пары. Соответственно, существует обменный (а) и донорно-акцепторный (б) механизмы образования ковалентной связи. Отдельным случаем является дативная связь, которая будет рассмотрена ниже.
Ковалентная связь: обменный механизм
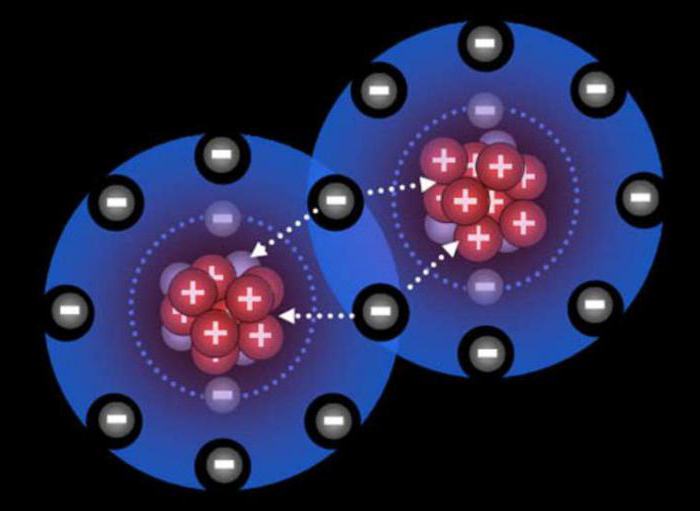
У атомов на внешнем уровне есть неспаренные электроны. При взаимодействии внешние оболочки перекрываются. Антипараллельные спины одиночных электронов, содержащихся на внешних уровнях, спариваются с образованием электронной пары, общей для обоих атомов. Данная пара электронов представляет, собственно, ковалентную связь, которая образована по обменному механизму, к примеру, в молекуле водорода.
Ковалентная связь: донорно-акцепторный механизм
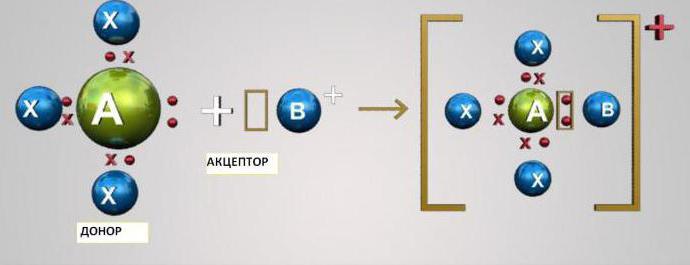
Данный механизм заключается в обобществлении двумя атомами двух находящихся на внешнем уровне электронов. При этом один из атомов выступает в качестве донора (предоставляет два электрона), а другой — акцептора (имеет вакантную орбиталь для электронов). Атомы s- и p-элементов могут быть либо акцепторами, либо донорами электронов. Атомы d-элементов способны быть и донорами, и акцепторами.
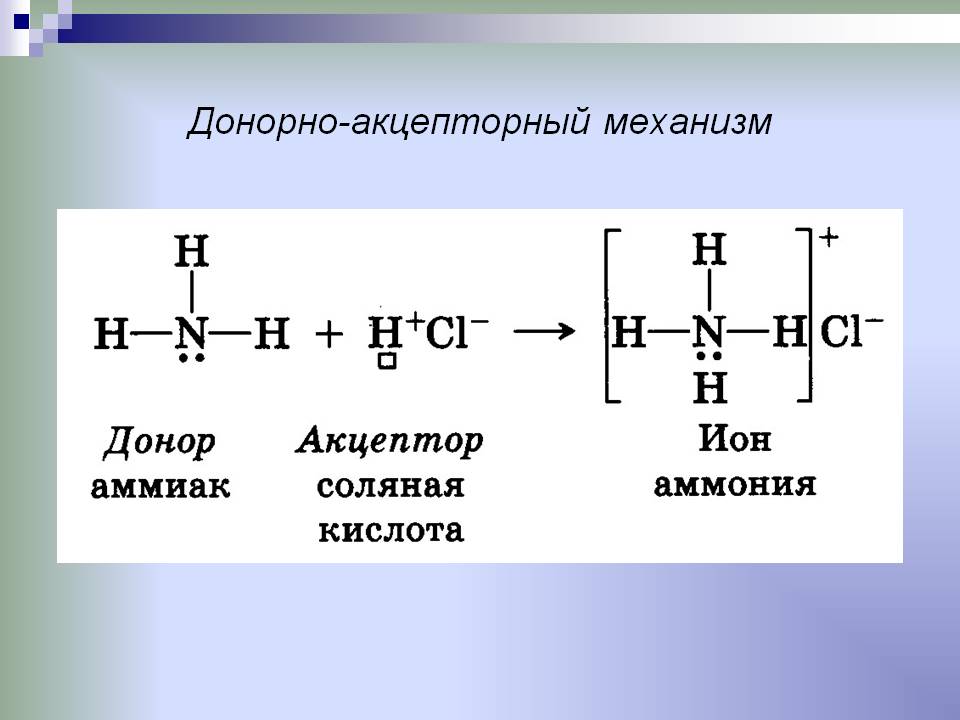
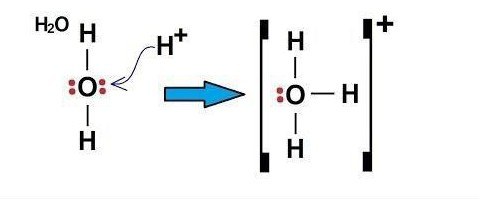
Чтобы понять, что такое донорно-акцепторный механизм, рассмотрим два простейших примера — образование катионов гидроксония H3O+ и аммония NH4+.
Пример донорно-акцепторного механизма — катион аммония
Схематически реакция образования частицы аммония выглядит следующим образом:
NH3+H+=NH4+
Электроны в атоме N распределены в следующем порядке: 1s2 2s2 2p3.
Электронная структура катиона H: 1s0.
Атом азота на внешнем уровне содержит два s- и три p-электрона. Три p-электрона участвуют в образовании трех ковалентных обменного типа связей азот-водород N-H. В результате этого образуется молекула аммиака NH3 с ковалентным типом связи. Поскольку атом азота N на внешнем уровне имеет еще пару электронов s, молекула NH3 может присоединить еще и катион водорода. Молекула аммиака является донором, а катион водорода H+ – акцептором, который принимает донорские электроны от азота на собственную свободную s-орбиталь.
Пример донорно-акцепторного механизма – h4O (ион гидроксония)
Электроны в атоме кислорода распределены в следующем порядке: 1s2 2s2 2p4.
Атом кислорода на внешнем уровне имеет два s и четыре p-электрона. Исходя из этого, в образовании связей H-O принимают участие два свободных p-электрона и два s-электрона от двух атомов H. То есть 2 имеющиеся связи в молекуле H2O – ковалентные, образованные по обменному механизму.
Электронная структура катиона водорода: 1s0.
Так как у атома кислорода на внешнем уровне остались еще два электрона (s-типа), он может образовать третью связь ковалентного типа по донорно-акцепторному механизму. Акцептором может быть атом, имеющий свободную орбиталь, в данном примере это частица H+. Свободную s-орбиталь катиона H+ занимают два электрона (s) атома кислорода.
Донорно-акцепторный механизм образования ковалентной связи между неорганическими молекулами
Донорно-акцепторный механизм ковалентной связи возможен не только во взаимодействиях типа «атом-атом» или «молекула-атом», но и в реакциях, протекающих между молекулами. Единственным условием для донорно-акцепторного взаимодействия кинетически независимых молекул является уменьшение энтропии, другими словами, повышение упорядоченности химической структуры.
Рассмотрим первый пример — образование апротонной кислоты (кислоты Льюиса) NH3BF3. Данный неорганический комплекс образуется в реакции присоединения молекулы аммиака и фторида бора.
NH3+BF3= NH3BF3
Электроны в атоме бора распределены в следующем порядке: 1s2 2s2 2p1.
При возбуждении атома B один электрон s-типа переходит на p-подуровень (1s2 2s1 2p2). Таким образом, на внешнем уровне возбужденного атома бора находится два s- и два p-электрона.
В молекуле BF3 три ковалентные связи бор-фтор B-F образованы обменного типа (атомы бора и фтора предоставляют по одному электрону). После образования трех ковалентных связей у атома бора на внешней электронной оболочке остается свободный p-подуровень, за счет которого молекула фторида бора может выступать акцептором электронов.
Электроны в атоме азота распределены в следующем порядке:1s2 2s2 2p3.
По три электрона от атомов N и H участвуют в формировании связи азот-водород. После этого у азота остается еще два электрона s-типа, которые он может предоставить для образования связи по донорно-акцепторному механизму.
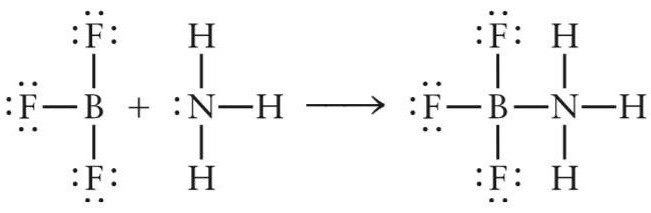
В реакции взаимодействия трифторида бора и аммиака молекула NH3 играет роль донора электронов, а молекула BF3 – акцептора. Пара электронов азота занимает свободную орбиталь фторида бора и образуется химическое соединение NH3BF3.
Другой пример механизма образования донорно-акцепторной связи — получение полимера фторида бериллия.
Схематически реакция выглядит следующим образом:
BeF2+BeF2+…+BeF2->(BeF2)n
Электроны в атоме Be расположены так — 1s2 2s2, а в атоме F — 1s2 2s2 2p5.
Две связи бериллий-фтор в молекуле фторида бериллия ковалентные обменного типа (участвуют два p-электрона от двух атомов фтора и два электрона s-подуровня атома бериллия).
Между парой атомов бериллия (Be) и фтора (F) формируются еще две ковалентные связи по донорно-акцепторному механизму. В полимере фторида бериллия атом фтора — это донор электронов, атом бериллия – их акцептор, имеющий вакантную орбиталь.
Донорно-акцепторный механизм образования ковалентной связи между органическими молекулами
Когда происходит формирование связи по рассматриваемому механизму между молекулами органической природы, образуются более сложные соединения — комплексы. В любом органическом соединении с ковалентной связью содержатся как занятые (несвязывающие и связывающие), так и пустые орбитали (разрыхляющие и несвязывающие). Возможность донорно-акцепторного образования комплексов определяется степенью устойчивости комплекса, которая зависит от прочности связи.
Рассмотрим пример — реакция взаимодействия молекулы метиламина с соляной кислотой с образованием хлорида метиламмония. В молекуле метиламина все связи ковалентные, образованные по обменному механизму – две связи H-N и одна связь N-CH3. После соединения с водородом и метильной группой у атома азота есть еще пара электронов s-типа. Являясь донором, он предоставляет эту электронную пару для атома водорода (акцептор), у которого есть свободная орбиталь.
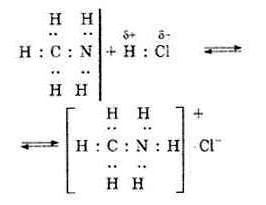
Донорно-акцепторный механизм без формирования химической связи
Не во всех случаях донорно-акцепторного взаимодействия происходит обобществление электронной пары и образование связи. Некоторые органические соединения могут объединяться между собой за счет перекрывания заполненной орбитали донора с пустой орбиталью акцептора. Происходит перенос заряда – электроны делокализуются между акцептором и донором, расположенными очень близко друг к другу. Образуются комплексные соединения с переносом заряда (КПЗ).
Такое взаимодействие характерно для пи-систем, орбитали которых легко перекрываются, а электроны легко поляризуются. В роли доноров могут выступать металлоцены, ненасыщенные аминосоединения, ТДАЭ (тетракис(диметиламино)этилен). Акцепторами зачастую являются фуллерены, хинодиметаны, имеющие акцепторные заместители.
Перенос заряда может быть как частичным, так и полным. Полный перенос заряда происходит при фотовозбуждении молекулы. При этом образуется комплекс, который можно наблюдать спектрально.
Независимо от полноты переноса заряда, такие комплексы неустойчивы. Для повышения прочности и времени жизни такого состояния дополнительно внедряют мостиковую группу. В результате этого донорно-акцепторные системы успешно используются в устройствах преобразования солнечной энергии.
В некоторых органических молекулах связь по донорно-акцепторному механизму формируется внутри молекулы между донорной и акцепторной группой. Такой тип взаимодействия носит название трансаннулярного эффекта, характерного, к примеру, для атранов (элементоорганические соединения со связями N->B, N->Si).
Семиполярная связь, или Дативный механизм образования связи
Кроме обменного и донорно-акцепторного существует третий механизм – дативный (другие названия – семиполярная, полуполярная или координационная связь). Атом-донор отдает пару электронов на свободную орбиталь нейтрального атома, которому необходимы два электрона, чтобы завершить внешний уровень. Происходит своеобразный переход электронной плотности от акцептора к донору. При этом донор становится положительно заряженным (катион), а акцептор – отрицательно заряженным (анион).
Собственно химическая связь формируется за счет связывающей оболочки (перекрывания двух спаренных электронов одного из атомов внешней свободной орбиталью другого) и электростатической притяжения, возникающего между катионом и анионом. Таким образом, в семиполярной связи сочетаются ковалентный и ионный типы. Полуполярная связь характерна для d-элементов, которые в разных соединениях могут играть роли и акцептора, и донора. В большинстве случаев она встречается в комплексных и органических веществах.
Примеры дативной связи
Самый простой пример – молекула хлора. Один атом Cl отдает пару электронов другому атому хлора, у которого есть свободная d-орбиталь. При этом один атом Cl заряжается положительно, другой – отрицательно, и между ними возникает электростатическое притяжение. Из-за большой длины дативная связь имеет меньшую прочность в сравнении с ковалентной обменного и донорно-акцепторного типа, но ее наличие повышает прочность молекулы хлора. Именно поэтому молекула Cl2 более прочна, чем F2 (у атома фтора нет d-орбиталей, связь фтор-фтор только ковалентная обменная).
Молекула монооксида углерода CO (угарный газ) образована за счет трех связей C-O. Поскольку у атомов кислорода и углерода на внешнем уровне имеется по два одиночных электрона, между ними формируется две ковалентные обменные связи. После этого у атома углерода остается вакантная орбиталь, у атома O — две пары электронов на внешнем уровне. Поэтому в молекуле монооксида углерода (II) есть третья связь – семиполярная, формирующаяся за счет двух валентных спаренных электронов кислорода и свободной орбитали углерода.
Рассмотрим более сложный пример — образование данного вида связи на примере взаимодействия диметилового эфира (Н3С-О-СН3) с хлоридом алюминия AlCl3. Атом кислорода в диметиловом эфире связан двумя ковалентными связями с метильными группами. После этого у него остается еще два электрона на p-подуровне, которые он отдает атому-акцептору (алюминий) и становится положительным катионом. При этом атом-акцептор приобретает отрицательный заряд (превращается в анион). Катион и анион электростатически взаимодействуют друг с другом.
Значение донорно-акцепторной связи
Механизм образования донорно-акцепторной связи имеет важное значение в жизни человека и широко распространен в химических соединениях как органической, так и неорганической природы, что подтверждают рассмотренные выше примеры. Нашатырный спирт, в составе которого есть катион аммония, успешно применяется в быту, медицине и промышленном производстве удобрений. Ион гидроксония играет главную роль в растворении кислот в воде. Угарный газ применяется в промышленности (например, при производстве удобрений, лазерных систем) и имеет огромное значение в физиологических системах организма человека.
Донорно-акцепторная связь
Возможен и другой механизм образования ковалентной связи – донорно-акцепторный. В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого атома. Рассмотрим в качестве примера механизм образования иона аммония (NH4+). В молекуле аммиака атом азота имеет неподеленную пару электронов (двухэлектронное облако)
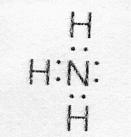
У иона водорода свободна (не запонена) 1s-орбиталь, что можно обозначить как Н+ (здесь квадрат означает ячейку). При образовании иона аммония двухэлектронное облако азота становится общим для атомов азота и водорода, то есть оно превращается в молекулярное электронное облако. А значит, возникает четвертая ковалентная связь. Процесс образования иона аммония можно представить схемой
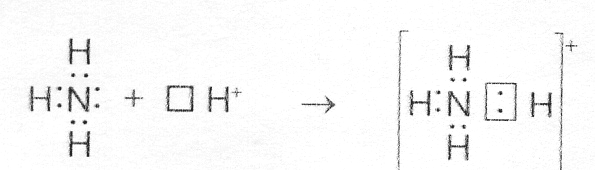
Заряд иона водорода становится общим (он делокализован, т.е. рассредоточен между всеми атомами), а двухэлектронное облако (неподеленная электронная пара), принадлежащая азоту, становится общей с Н+. В схемах изображение ячейки часто опускается.
Атом, предоставляющий неподеленную электронную пару, называется донором, а атом, принимающий ее (то есть предоставляющий свободную орбиталь), называется акцептором.
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным. Образованная таким путем ковалентная связь называется донорно-акцепторной или координационной связью.
Однако это не особый вид связи, а лишь иной механизм (способ) образования ковалентной связи. По свойствам четвертная связь N-H в ионе аммония ничем не отличается от остальных трех.
Большей частью донорами являются молекулы, содержащие атомы N, O, F, Cl связанные в ней с атомами других элементов. Акцептором может быть частица, обладающая вакантными электронными уровнями, например, атомы d-элементов, обладающие незаполненными d-подуровнями.
Свойства ковалентной связи
Длина
связи –
это межъядерное расстояние. Химическая
связь тем прочнее, чем меньше ее длина.
Длина связи в молекулах составляет:
НС3-СН3 1,54 ;
Н2С=СН2
;
Н2С=СН2
1,33  ;
НС≡СН 1,20
;
НС≡СН 1,20 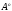 .В
пересчете на одинарные связи эти величины
увеличиваются, реакционная способность
соединений с кратными связями возрастает.
Мерой прочности связи является энергия
связи.
.В
пересчете на одинарные связи эти величины
увеличиваются, реакционная способность
соединений с кратными связями возрастает.
Мерой прочности связи является энергия
связи.
Энергия связи определяется количеством энергии, которое необходимо для разрыва связи. Обычно она измеряется в килоджоулях, отнесенных к 1 молю вещества. С увеличением кратности связи энергия связи увеличивается, а ее длина уменьшается. Величины энергии связи в соединениях (алканы, алкены, алкины): С-С 344 кДж/моль; С=С 615 кДж/моль; С≡С 812 кДж/моль. То есть энергия двойной связи меньше удвоенной энергии одинарной связи, а энергия тройной связи меньше утроенной энергии одинарной связи, поэтому алкины более реакционноспособны из этой группы углеводородов.
Под насыщаемостью понимают способность атомов образовывать ограниченное число ковалентных связей. Например, атом водорода (один неспаренный электрон) образует одну связь, атом углерода (четыре неспаренных электрона в возбужденном состоянии) – не более четырех связей. Вследствие насыщаемости связей молекулы имеют определенный состав: Н 2, СН4, НСl и т.д. Однако и при насыщенных ковалентных связях могут образовываться более сложные молекулы по донорно-акцепторному механизму.
Направленность ковалентной связи обусловливает пространственную структуру молекул, то есть их форму. Рассмотрим это на примере образования молекул HCl, H2O, NH3.
Согласно МВС, что ковалентная связь возникает в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов. При образовании молекулы НСl происходит перекрывание s-орбитали атома водорода с р-орбиталью атома хлора. Молекулы такого типа имеют линейную форму.
На
внешнем уровне атома кислорода имеются
два неспаренных электрона. Орбитали их
взаимно перпедикулярны, т.е. располагаются
относительно друг друга под углом 90о.
При образовании молекулы воды орбиталь
каждого р-электрона перекрывается
1s-орбиталью
атома водорода вдоль линии осей координат.
Химические связи в этом случае должны
быть направлены под углом 90
Таким образом, атом кислорода с двумя неспаренными (валентными) р-элект-ронами образует с водородом молекулы воды, которая имеет угловую форму. Очевидно, молекулы такой же формы должны образовывать с водородом аналоги кислорода – сера, селен, теллур.
В образовании молекулы NH3 участвуют три неспаренных р-электрона атома азота, электронные орбитали которых также взаимно перпендикулярны, и 1s-электроны трех атомов водорода.
Связи располагаются вдоль трех осей р-орбиталей. Молекула имеет форму правильной пирамиды, в углах треугольника находится атомы водорода, в вершине пирамиды – атом азота. Угол между связями ے Н-N-Н = 107,3о. Молекулы такой же формы (но с другим значением угла) образуют с водородом аналоги азота – фосфор, мышьяк, сурьма.

Образование молекул NH3 и Н2О
Готовимся к углубленному изучению химии : 3.9 Донорно-акцепторный механизм образования
3.9. Донорно-акцепторный механизм образования ковалентной связи. Ионная, металлическая, водородная связи. Межмолекулярные взаимодействия. Типы кристаллических решеток Донорно-акцепторный механизм образования связи Существует еще один механизм образования связи. Рассмотрим его на примере взаимодействия молекулы аммиака с молекулой трифторида бора: У атома азота в молекуле аммиака после образования связей с атомами водорода остается еще одна валентная орбиталь с неподеленной парой электронов (в структурной формуле обозначена точками). У атома бора в молекуле трифторида бора после образования связей с атомами фтора остается одна свободная валентная орбиталь (в структурной формуле обозначена • ). Неподеленную пару валентных электронов атом азота может предоставить атому бора » в совместное использование» , » поделиться» с ним этой электронной парой. При этом электроны бывшей неподеленной пары становятся общими для атомов азота и бора, то есть между ними образуется ковалентная связь. Но при этом у атомов бора и азота возникают еще и формальные заряды: – 1 е у атома бора и +1 е у атома азота: В результате между атомами азота и бора возникает и ковалентная, и ионная связь. При этом атом азота является| Донорно-акцепторный механизм образования связи – механизм образования связи, при котором один из связываемых атомов является донором электронной пары, а другой – акцептором. |
Конечно, после образования связи за счет разницы в электроотрицательности связываемых атомов происходит поляризация связи, возникают частичные заряды, снижающие эффективные (реальные) заряды атомов. Рассмотрим другие примеры. Если рядом с молекулой аммиака окажется сильно полярная молекула хлороводорода, в которой на атоме водорода имеется значительный частичный заряд , то в этом случае роль акцептора электронной пары будет выполнять атом водорода. Его 1s-АО хоть и не совсем пустая, как у атома бора в предыдущем примере, но электронная плотность в облаке этой орбитали существенно понижена. Пространственное строение получившегося катиона, иона аммония NH4, подобно строению молекулы метана, то есть все четыре связи N—H совершенно одинаковы.
Образование ионных кристаллов хлорида аммония NH
В заключение рассмотрим электронное строение молекулы угарного газа (монооксида углерода) СО: В ней, кроме трех ковалентных связей (тройной связи), есть еще и ионная связь.
Условия образования связи по донорно-акцепторному механизму:
1) наличие у одного из атомов неподеленной пары валентных электронов;
2) наличие у другого атома свободной орбитали на валентном подуровне.
Донорно-акцепторный механизм образования связи распространен довольно широко. Особенно часто он встречается при образовании соединений d-элементов. Атомы почти всех d-элементов имеют много свободных валентных орбиталей. Поэтому они являются активными акцепторами электронных пар. ДОНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ ОБРАЗОВАНИЯ СВЯЗИ, ИОН АММОНИЯ, ИОН ОКСОНИЯ, УСЛОВИЯ ОБРАЗОВАНИЯ СВЯЗИ ПО ДОНОРНО-АКЦЕПТОРНОМУ МЕХАНИЗМУ. · ОБМЕННЫЙ МЕХАНИЗМ — в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет в общее пользование по одному электрону: · ДOНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ — образование связи происходит за счет пары электронов атома-донора и вакантной орбитали атома-акцептора: Характеристики ковалентной связи не зависят от механизма ее образования. ИОННЫЙ ТИП ХИМИЧЕСКОЙ СВЯЗИ Чисто ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается путём полного перехода общей электронной плотности к атому более электроотрицательного элемента.
На практике полный переход электрона от одного атома к другому атому-паренеру по связи не реализуется, поскольку каждый элемент имеет большую или меньшую, но не нулевую, электроотрицательность, илюбая связь будет в некоторой степени ковалентной.
Ионная связь возможна только между атомами электроположительных и электроотрицательных элементов, находящихся в состоянии разноименно заряженных ионов.
Ионы — это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или присоединени электронов.При отдаче электронов образуется положительно заряженный ион-катион, при присоединении-отрицательный-анион.
При отдаче или присоединении электронов молекулами образуются молекулярные или многоатомные ионы, например О2+ — катион диоксигенила, NO2--нитрит-ион.
Одноатомные катионы и одноатомные анионы возникают при химической реакции между нейтральнами атомами путем взаимопередачи электронов. При этом атом электроположительного элемента, обладающий небольшим числом внешних электронов, переходит в более устойчивое состояние одноатомного катиона путем уменьшения числа этих электронов. Наоборот, атом электроотрицательного элемента, имеющий большое число электроно на внешнем слое , переходит в более устойчивое для него состояние одноатомного иона путем увеличения числа электронов.
Одноатомные катионы образуются, как правило, металлами, а одноатомные анионы-неметаллами. При передаче электронов металлического и неметаллического элементов стремятся сформировать вокруг своих ядер устойчивую конфигурацию электронной оболочки. Атом неметаллического элемента создает внешнюю оболочку последующего благородного газа, тогда как атом металлического элемента после отдачи внешних электронов получает устойчивую конфигурацию предыдущего благородного газа. Схема образования ионной связи Кулоновские силы притяжения, возникающие при взаимодействии заряженных ионов, сильные и действуют одинаково во всех направлениях. В результате этого расположение ионов упорядочивается в пространстве определенным образом, образуя ионную кристаллическую решётку. Вещества с ионной КР при обычных условиях находятся в кристаллическом состоянии, они имеют высокие температуры плавления и кипения.
Катионы в металлических решётках не обладают поступательным движением, а совершают колебания вокруг положения узлов решётки. Амплитуда этих колебаний возрастает при повышении температуры, а при достижении температуры плавления металла решётка разрушается. Температура плавления металлов, как правило возрастает с увеличением числа валентных электронов в их атомах. ВОДОРОДНЫЙ ТИП ХИМИЧЕСКОЙ СВЯЗИ ВОДОРОДНАЯ СВЯЗЬ (Н-связь) – особый тип взаимодействия между реакционно-способными группами, при этом одна из групп содержит атом водорода, склонный к такому взаимодействию. Водородная связь – глобальное явление, охватывающее всю химию. В отличие от обычных химических связей, Н-связь появляется не в результате целенаправленного синтеза, а возникает в подходящих условиях сама и проявляется в виде межмолекулярных или внутримолекулярных взаимодействий. Отличительная черта водородной связи – сравнительно низкая прочность, ее энергия в 5–10 раз ниже, чем энергия химической связи. По энергии она занимает промежуточное положение между химическими связями и Ван-дер-ваальсовыми взаимодействиями, теми, что удерживают молекулы в твердой или жидкой фазе. Для возникновения водородных связей важно, чтобы в молекулах вещества были атомы водорода, связанные с небольшими, но электроотрицательными атомами, например: O, N, F. Это создает заметный частичный положительный заряд на атомах водорода. С другой стороны, важно, чтобы у электроотрицательных атомов были неподеленные электронные пары. Когда обедненный электронами атом водорода одной молекулы (акцептор) взаимодействует с неподеленной электронной парой на атоме N, O или F другой молекулы (донор), то возникает связь, похожая на полярную ковалентную. Водородные связи между молекулами воды (обозначены пунктиром) Объемная модель, показывающая расположение молекул воды, связанных водородными связями Учитывая заметную разницу зарядов на атомах Н и О соседних молекул, дополнительную прочность этой межмолекулярной связи придает притяжение разноименных зарядов. Водородные связи характерны для таких веществ, как вода H2O, аммиак NH3, фтороводород HF. В водных растворах аммиака или HF эти молекулы образуют водородные связи не только между собой, но и с молекулами воды. Благодаря водородным связям аммиак NH3 имеет фантастическую растворимость: в 1 л воды может растворяться 750 л газообразного аммиака! В органических веществах встречаются также внутримолекулярные водородные связи, сильно влияющие на пространственную форму этих молекул. Межмолекулярное взаимодействие Межмолекулярное взаимодействие — взаимодействие молекул между собой, не приводящее к разрыву или образованию новых химических связей. В их основе, как и в основе химической связи, лежат электрические взаимодействия. Силы Ван-дер-Ваальса включают все виды межмолекулярного притяжения и отталкивания. Они получили название в честь Я.Д. Ван-дер-Ваальса, который первым принял во внимание межмолекулярные взаимодействия для объяснения свойств реальных газов и жидкостей. Эти силы определяют отличие реальных газов от идеальных, существование жидкостей и молекулярных кристаллов. От них зависят многие структурные, спектральные и другие свойства веществ. Основу ван-дер-ваальсовых сил составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой. На определенном расстоянии между молекулами силы притяжения и отталкивания уравновешивают друг друга, и образуется устойчивая система. Ван-дер-ваальсовы силы заметно уступают химическому связыванию. Например, силы, удерживающие атомы хлора в молекуле хлора почти в десять раз больше, чем силы, связывающие молекулы Cl2 между собой. Но без этого слабого межмолекулярного притяжения нельзя получить жидкий и твердый хлор.
Ориентационное взаимодействие
Полярные молекулы, в которых центры тяжести положительного и отрицательного зарядов не совпадают, например HCl, H2O, NH3, ориентируются таким образом, чтобы рядом находились концы с противоположными зарядами. Между ними возникает притяжение. Для взаимодействия двух диполей энергия притяжения между ними (энергия Кеезома) выражается соотношением: EК = −2 μ1 μ2 / 4π ε0 r3, где μ1 и μ2 — дипольные моменты взаимодействующих диполей, r — расстояние между ними. Притяжение диполь-диполь может осуществляться только тогда, когда энергия притяжения превышает тепловую энергию молекул; обычно это имеет место в твердых и жидких веществах. Диполь-дипольное взаимодействие проявляется в полярных жидкостях (вода, фтороводород).Индукционное взаимодействие
Если рядом с полярная молекула окажется полярная рядом с неполярными, она начнет влиять на них. Поляризация нейтральной частицы под действием внешнего поля (наведение диполя) происходит благодаря наличию у молекул свойства поляризуемости γ. Постоянный диполь может индуцировать дипольное распределение зарядов в неполярной молекуле. Под действием заряженных концов полярной молекулы электронные облака неполярных молекул смещаются в сторону положительного заряда и подальше от отрицательного. Неполярная молекула становится полярной, и молекулы начинают притягиваться друг к другу, только намного слабее, чем две полярные молекулы. Энергия притяжения между постоянным и наведенным диполем (энергия Дебая) определяется выражением: EД = −2 μнав2 γ / r6, где μнав — момент наведенного диполя. Притяжение постоянного и наведенного диполей обычно очень слабое, поскольку поляризуемость молекул большинства веществ невелика. Оно действует только на очень малых расстояниях между диполями. Этот вид взаимодействия проявляется главным образом в растворах полярных соединений в неполярных растворителях.Дисперсионное взаимодействие
Между неполярными молекулами также может возникнуть притяжение. Электроны, которые находятся в постоянном движении, на миг могут оказаться окажется сосредоточенными с одной стороны молекулы, то есть неполярная частица станет полярной. Это вызывает перераспределение зарядов в соседних молекулах, и между ними устанавливаются кратковременные связи: Энергия такого взаимодействия (энергия Лондона) дается соотношением: EЛ = −2 μмгн2 γ2 / r6, где μмгн — момент мгновенного диполя. Лондоновские силы притяжения между неполярными частицами (атомами, молекулами) являются весьма короткодействующими. Значения энергии такого притяжения зависят размеров частиц и числа электронов в наведенных диполях. Эти связи очень слабые — самые слабые из всех межмолекулярных взаимодействий. Однако они являются наиболее универсальными, так как возникают между любыми молекулами. КРИСТАЛЛИЧЕСКИЕ РЕШЁТКИ Из курса физики вы знаете, что вещества могут существовать в трёх агрегатных состояниях:твёрдм, жидком, газообразном. В данном параграфе рассмотрим кристаллические вещества, т.е. вещества, находящиеся в твёрдом состоянии. Они образуют кристаллические решётки.Кристаллические решётки веществ-это упорядоченное расположение частиц(атомов, молекул, ионов) в строго определённых точках пространства. Точки размещния частиц называют узлами кристаллической решётки.
В зависимости от типа частиц, расположенных в узлах кристаллической решётки, ихарактера связи между ними различают 4 типа кристаллических решёток: ионные, атомные, молекулярные, металлические. Рассмотрим каждую из решёток в отдельности и поподробней.
| Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью. Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов. |
| Рассмотрим строение кристалла поваренной соли, в узлах которого находятся ионы хлора и натрия. Связи между ионами в кристалле очень прочные и устойчивые.Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи. |
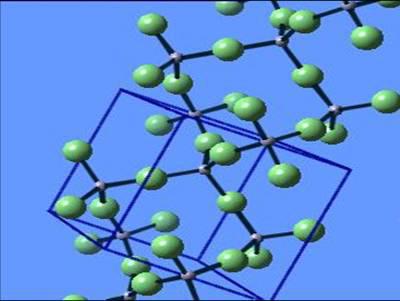
| Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными связями.Ниже показана кристаллическая решётка алмаза. |
| В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры плавления, обладают повышенной твёрдостью. Алмаз-самый твёрдый природный материал. |
| Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них ковалентные, как полярные, так и неполярные. Связи в молекулах прочные, но между молекулами связи не прочные. Ниже представлена кристаллическая решётка I2 |
| Вещества с МКР имеют малую твёрдость, плавятся при низкой температуре, летучие, при обычных условиях находятся в газообразном или жидком состоянии |
| МЕТАЛЛИЧЕСКИЕ |
| Металлическими называют решётки, в узлах которых находятся атомы и ионы металла. |
| Для металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность. Типы кристаллических решеток твердых веществ |
а) бромида аммония NH4Br из аммиака и бромоводорода;
б) сульфата аммония (NH4)2SO4 из аммиака и серной кислоты. 2. Напишите молекулярные формулы следующих соединений: 3. Какое из двух соединений ковалентное, а какое — полярное ковалентное: F-F, Cl-F ? 4. Какова прочность связи между частицами кристаллов в молекулярной, ионной, атомной и металлической кристаллических решетках. 5. Назовите известные вам виды межмолекулярного взаимодействия. 6. Какие частицы находятся в узлах молекулярной, ионной, атомной и металлической кристаллических решеток. 7. Приведите примеры веществ, которые в твердом состоянии имеют молекулярную, ионную, атомную и металлическую кристаллические решетки. 8. Какие их следующих веществ являются ионными соединениями: Почему? Напишите схемы образования этих соединений. 9. Отличаются ли свойства донорно-акцепторной связи от свойств обычной ковалентной связи.
10.
| 1. Какие связи присутствуют в NH4Cl: | |
| а) ковалентные неполярные | |
| в) ковалентные полярные | г) металлические |
| 2. Какая связь возникает при взаимодействии между собой атомов элементов с конфигурацией валентных электронов …3d54s2 и 3d64s2: | |
| б) ковалентная полярная | |
| г) металлическая | |
| 3. Вещества с какими типами химических связей могут образовывать молекулярную кристаллическую решетку: | |
| а) ковалентной полярной | |
| г) металлической | |
| 4. Укажите формулы веществ с ионной связью: | |
| б) все ответы верны | |
| 5. В каком ряду названы вещества с атомной, молекулярной и ионной кристаллическими решетками в твердом состоянии: | |
| а) алмаз, хлорид натрия, графит | б) белый фосфор, вода, водород |
| в) оксид кремния (IV), медь, азот | г) алмаз, фтор, фторид калия |
| 6. Укажите формулы молекул или ионов, в которых присутствуют ковалентные связи, образованные по донорно-акцепторному механизму: | |
| б) все ответы верны | |
| 7. Охарактеризуйте свойства вещества с молекулярной кристаллической решеткой: | |
| а) легкоплавкое | б) растворимое |
| в) хорошо проводит электрический ток | г) тугоплавкое |
| 8. Охарактеризуйте строение иона аммония и химические связи в нем: | |
| а) валентность атома азота равна IV | б) степень окисления атома азота равна -3 |
| в) все ответы верны | г) все связи ковалентные полярные |
| 9. Между элементами с атомными номерами 3 и 9 возникает связь: | |
| а) ковалентная | |
| в) металлическая | |
| 10. Сколько валентных электронов атомов азота и водорода в сумме участвуют в образовании химической связи в молекуле аммиака: | |
Донорно-акцепторная связь — это… Что такое Донорно-акцепторная связь?
Донорно-акцепторный механизм (иначе координационный механизм) — способ образования ковалентной химической связи между двумя атомами или группой атомов, осуществляемый за счет неподеленной пары электронов атома-донора и свободной орбитали атома-акцептора.
Термины «донорно-акцепторная связь» или «координационная связь» некорректны, поскольку это не есть вид химической связи, а лишь теоретическая модель, описывающая особенность её образования. Свойства ковалентной химической связи, образованной по донорно-акцепторному механизму, ничем не отличаются от свойств связей, образованных по обменному механизму (например, связи N—H в аммонии (NH4+) или связи O—H в гидроксонии (Н3O+)).
Донорами обычно выступают атомы азота, кислорода, фосфора, серы и др., имеющие неподелённые электронные пары на валентных орбиталях малого размера. Роль акцептора могут выполнять ионизированный атом водорода H+, некоторые p-металлы (напр., алюминий при образовании иона AlH4—) и, в особенности, d-элементы, имеющие незаполненные энергетические ячейки в валентном электронном слое.
Именно с позиций донорно-акцепторного механизма описывается образование локализованных ковалентных связей в молекулах и молекулярных ионах комплексных (координационных) соединений: связь формируется за счёт неподелённой пары электронов лиганда и свободной орбитали атома-комплексообразователя. Донорно-акцепторный механизм также описывает образование промежуточных продуктов (интермедиатов) реакции, например, комплексов с переносом заряда.
Модель донорно-акцепторного механизма существует только в рамках представлений о валентности как о локализации электронной плотности при образовании ковалентных связей (метод валентных схем). В рамках метода молекулярных орбиталей необходимости в подобных представлениях нет.
См. также
Разница между Донорными и Акцепторными примесями
Основное различие между Донорными и Акцепторными примесями заключается в том, что элементы в группе V периодической таблицы элементов обычно действуют как Донорные примеси (отдающие), тогда как элементы в группе III обычно действуют как Акцепторные примеси (принимающие).
Легирование полупроводников — это процесс, при котором добавляются примеси в полупроводник. Легирование используется для увеличения проводимости полупроводника. Существует две основные формы примесей: Донорные и Акцепторные. При донорном легировании добавляются Донорные примеси, тогда как при акцепторном легировании добавляются Акцепторые примеси.
Содержание
- Обзор и основные отличия
- Что такое Донорные примеси
- Что такое Акцепторные примеси
- В чем разница между Донорными и Акцепторными примесями
- Заключение
Что такое Донорная примесь?
Донорные примеси — это донорные (отдающие) химические элементы, добавляемые к полупроводнику для увеличения его электропроводности. Элементы в V группе периодической таблицы элементов являются общими донорными примесями. Донором является атом или группа атомов, которые могут образовывать области n-типа (от англ. «negativ» — что переводится как «отрицательный») при добавлении в полупроводник. Типичным примером является кремний (Si).
 Кремний с Донорной примесью фосфора
Кремний с Донорной примесью фосфораК элементам V группы, которые часто служат в качестве донорных примесей, относятся мышьяк (As), фосфор (P), висмут (Bi) и сурьму (Sb). Эти элементы имеют пять электронов в своей внешней электронной оболочке (у них есть пять валентных электронов). При добавлении одного из этих примесных элементов к кремнию, образуется четыре ковалентные связи.
Но теперь есть свободный электрон, так как было пять валентных электронов. Этот электрон так и останется свободным электроном, что увеличит проводимость полупроводника. Число примесных атомов определяет количество свободных электронов, присутствующих в доноре.

Что такое Акцепторная примесь?
Акцепторная примесь представляют собой акцепторные (принимающие) химические элементы, добавляемые в полупроводник для увеличения его электропроводности. Элементы в III группе периодической таблицы элементов используются в качестве акцепторных примесей. Эти элементы включают алюминий (Al), бор (B) и галлий (Ga). Акцептор представляет собой легирующую примесь, которая образует области р-типа (от англ. «positiv» — что переводится как «положительный») при добавлении в полупроводник. Атомы акцепторных примесей имеют три валентных электрона в своих внешних электронных оболочках.
 Кремний с Акцепторной примесью бора
Кремний с Акцепторной примесью бораПри добавлении в полупроводник акцепторного атома примеси, например такого как алюминий, он заменяет атомы кремния в полупроводнике. Перед этим атом кремния имеет вокруг себя четыре ковалентные связи. Когда атом алюминия занимает положение кремния, этот атом алюминия образует только три ковалентные связи, что, в свою очередь, приводит к образованию свободной вакансии ковалентной связи у соседних атомов. Эта свободная вакансия называется дыркой. Из соседней ковалентной связи на место свободной дырки может перескочить электрон. Эти дырки используются при прохождении электричества через полупроводник. При прохождении электричества в полупроводнике происходит хаотическое блуждание дырок.
Когда число добавленных примесных атомов увеличивается, число дырок, присутствующих в полупроводнике, также увеличивается. Это добавление примеси, увеличивает проводимость в полупроводнике. После завершения процесса легирования полупроводник становится внешним (легированным) полупроводником.
В чем разница между Донорными и Акцепторными примесями?
| Донорные против Акцепторных примесей | |
| Донорные примеси — это донорные элементы, добавляемые к полупроводнику для увеличения его электропроводности | Акцепторные примеси представляют собой акцепторные элементы, добавляемые к полупроводнику для увеличения его электропроводности |
| Распространенные примеси | |
| Элементы V группы | Элементы III группы |
| Примеры примесей | |
| Мышьяк (As), фосфор (P), висмут (Bi) и сурьма (Sb) | Алюминий (Al), бор (B) и галлий (Ga) |
| Процесс | |
| Увеличение свободных электронов в полупроводнике | Увеличение дырок в полупроводнике |
| Валентные Электроны | |
| Атомы имеют пять валентных электронов | Атомы имеют три валентных электрона |
| Ковалентное соединение | |
| Образует четыре ковалентные связи внутри полупроводника, оставляя пятый электрон в качестве свободного электрона | Образует три ковалентные связи внутри полупроводника, оставляя дырку, где ковалентная связь отсутствует |
Заключение — Донорные против Акцепторных примесей
Полупроводники — это материалы, занимающие промежуточное место между диэлектриками, который не является проводником, и проводниками. Доноры и Акцепторы — это легирующие примеси, которые образуют проводящие электрический ток области в полупроводниках. Легирование Донором или Акцептором — это процессы, которые увеличивают электропроводность полупроводника. Основное различие между Донорными и Акцепторными примесями заключается в том, что элементы в III группе периодической таблицы действуют как Донорные примеси, тогда как элементы в V группе действуют как Акцепторные примеси.
Донорно-акцепторный механизм
Донорно-акцепторный механизм – образование ковалентной связи за счёт двухэлектронного облака одного атома(донор) и свободной орбитали другого(акцептор).
Примерами образования химической связи по донорно-акцепторному механизму являются:
а) реакция аммиака с ионом водорода:
H+ + ׃NH3 = NH4+
Роль акцептора электронной пары играет пустая орбиталь иона водорода. В ионе аммония NH4+ атом азота четырехвалентен.
б) такая связь образуется между атомом азота в молекуле метиламина CH3NH2 и протоном H+ кислоты HCl:
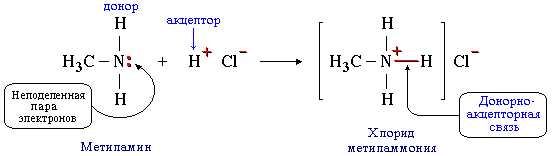
Атом азота отдает свою электронную пару на образование связи и выступает в роли донора, а протон предоставляет вакантную орбиталь, играя роль акцептора. Атом-донор при этом приобретает положительный заряд.
в) реакция валентно насыщенных соединений аммиака и трифторида бора:
F3B + ׃NH3 = F3B׃NH3
акцептор донор1
В молекуле аммиака заселены все четыре орбитали азота, из них три – по обменному механизму электронами азота и водорода, а одна содержит электронную пару, оба электрона которой принадлежат азоту. Такая электронная пара называется неподеленной электронной парой. Образование соединения H3N · BF3 происходит за счет того, что неподеленная электронная пара аммиака занимает вакантную орбиталь фторида бора. При этом уменьшается потенциальная энергия системы и выделяется эквивалентное количество энергии.
В соединении H3N · BF3 азот и бор – четырехвалентны. Атом азота повышает свою валентность от 3 до 4 в результате использования неподеленной электронной пары для образования дополнительной химической связи. Атом бора повышает валентность за счет наличия у него свободной орбитали на валентном электронном уровне. Таким образом, валентность элементов определяется не только числом неспаренных электронов, но и наличием неподеленных электронных пар и свободных орбиталей на валентном электронном уровне.
Донорно-акцeпторная связь отличается только способом образования; по свойствам она одинакова с остальными ковалентными связями.
Сeмипoлярная связь является разновидностью донорно-акцепторной связи. Образование этой связи происходит при взаимодействии атома-донора пары электронов и атома-акцептора, не имеющих формальных зарядов. При этом на атоме-доноре возникает положительный заряд, а на атоме-акцепторе, предоставившем вакантную орбиталь, – отрицательный.
Например:

Атом кислорода в молекуле диметилового эфира (CH3)2O отдает свою неподеленную пару электронов для образования связи с атомом алюминия, имеющим во внешнем слое только 6 электронов и готовым его дополнить до 8 в соответствии с правилом октета). В результате на атоме кислорода появляется положительный заряд, а на атоме алюминия – отрицательный. Противоположные по знаку заряды на ковалентно-связанных атомах вызывают их дополнительное электростатическое притяжение (ионную связь).
Сочетание ковалентной и ионной связей называют сeмиполярной связью.
К семиполярным связям относится также связь азот-кислород в нитрогруппе NO2, входящей в состав азотной кислоты HO–NO2, ее солей и эфиров, а также нитросоединений R–NO2:
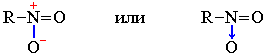
В приведенных формулах нитросоединения связи азота с кислородом неравноценны. Однако, как показывают результаты физических исследований, эти связи энергетически совершенно одинаковы. Следовательно, электронная пара, обусловливающая отрицательный заряд, не сосредоточена целиком на каком-либо одном кислородном атоме, а несколько смещена к азоту при одновременном смещении от азота ко второму кислородному атому подвижной π-электронной пары двойной связи. В результате выравнивания электронной плотности в нитрогруппе формальный отрицательный заряд (-1) распределяется поровну (-1/2) между обоими атоми кислорода:

В плоском треугольном ионе (NO3)— делокализованные π-связи равномерно распределяются между всеми атомами кислорода. Точно также делокализованные π-связи равномерно распределяются между всеми атомами кислорода в соединениях (BO3)3- ,(CO3)2-,SO3 , в BF3 – между всеми атомами фтора,в анионах (PO4)3- и (SO4)2- , имеющих тетраэдрическое строение делокализованные связи равномерно распределяются между всеми атомами кислорода
( рис.2 )
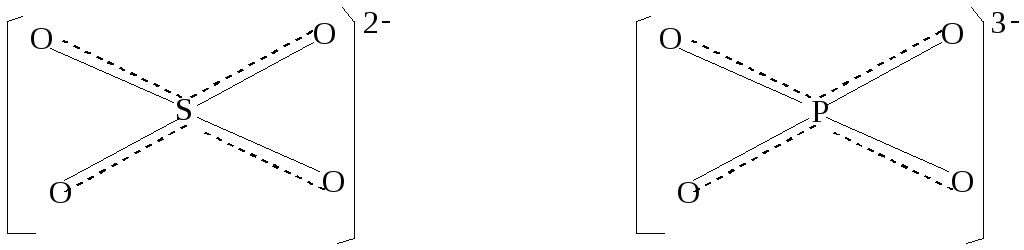
Рис.2 Структурные формулы некоторых с соединений с учётом делокализации π-связи.

